Александр Артеменко - Удивительный мир органической химии
- Название:Удивительный мир органической химии
- Автор:
- Жанр:
- Издательство:Дрофа
- Год:2005
- Город:Москва
- ISBN:5-7107-9540-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Александр Артеменко - Удивительный мир органической химии краткое содержание
Книга адресована старшеклассникам, учителям, а также тем, кто интересуется органической химией.
Удивительный мир органической химии - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
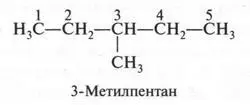
А теперь поступим так: в третьем изомере «разорвем» связь между первым и вторым углеродными атомами, а образовавшуюся метильную группу «присоединим» к третьему углеродному атому. Это — четвертый изомер, у которого главная цепь стала еще короче.
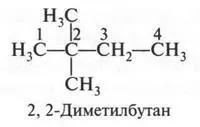
В этом изомере со вторым углеродным атомом связаны три метильные группы. Если же метальную группу «присоединим» не ко второму углеродному атому (как мы поступили, образуя четвертый изомер), а к третьему, то получим пятый изомер.
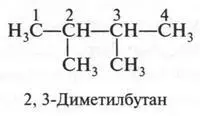
Итак, углеводород состава С 6Н 14имеет пять изомеров: один — нормальный (т. е. неразветвленный) и четыре — разветвленные. Других изомеров у этого углеводорода нет.
Отличаются ли эти изомеры по химическим и физическим свойствам? По химическим — практически нет, а по физическим — отличаются. Так, бутан кипит при — 0,5 °С, а изобутан — при — 11,4 °С. Точки кипения изомеров углеводорода С 6Н 14равны соответственно: 68, 60,3, 63,3, 49,7 и 58 °С. Интересно, что температуры кипения изомеров разветвленного строения имеют более низкие значения, чем нормального строения. Все это является доказательством того, что строение молекулы определяет свойства вещества. Это является одним из основных положений теории А. М. Бутлерова.
Число изомеров очень быстро растет с увеличением числа углеродных атомов в молекуле. Например, у углеводорода С 10Н 22изомеров 75, а у С 20Н 42число возможных изомеров достигает 366 319, у С 30Н 62их уже 4 111 846 763, а для соединения С 40Н 82изомеров более 60 триллионов!
Химики, конечно, не ставят себе целью получить все эти изомеры. Это просто невозможно, да и в этом нет необходимости. Подавляющее большинство изомеров, особенно с большим числом углеродных атомов, имеют лишь теоретический интерес. Поэтому многие из них существуют пока только на бумаге. Однако некоторые изомеры все же получены. Так, вначале были синтезированы все изомеры пентана (С 5Н 12). Синтез всех изомерных гептанов (С 7Н 16) был завершен позже — в 1929 г., изомерных октанов (С 8Н 18) — к 1933 г., а изомерных нонанов (С 9Н 20) — только к 1946 г. Что же касается высших углеводородов, то для них были получены только по несколько изомеров.
Необходимо сказать о том, что при выводе изомерных формул нельзя принимать искривление формулы за появление нового изомера. Например, формулы
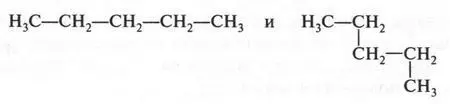
выражают одно и то же вещество — пентан.
Кстати, выводить изомерные формулы на бумаге легко, а вот получать изомерные вещества в лаборатории — совсем другое дело! Это очень трудная работа.
Итак, мы познакомились с самым простым видом изомерии — структурной изомерией, или изомерией углеродной цепи. В этом случае, как мы видим, изомеры отличаются друг от друга только строением цепи, состоящей из углеродных атомов. Однако в органической химии су-шествуют и другие, более сложные виды изомерии. Посмотрите на формулы этих соединений:

Эти формулы выражают строение двух изомерных спиртов. В первом из них (пропанол-1) гидроксильная группа (—ОН) связана с первым углеродным атомом, во втором (пропанол-2) — со вторым. Такой вид изомерии называется изомерией положения. Помните, мы говорили о двух изомерных кислотах — гремучей и циановой? А теперь посмотрите на их структурные формулы.

В гремучей кислоте гидроксильная группа связана с атомом азота, а в циановой кислоте — с атомом углерода. Это тоже изомерия положения. Однако и гремучая кислота, и циановая кислота имеют одну и ту же эмпирическую формулу (CHNO), несмотря на то что они различаются по химическим свойствам.
А вот еще пример изомерии положения. Известно, что у этилового спирта и диметилового эфира одна и та же эмпирическая формула — С 2Н 6O. Однако структурные формулы этих соединений совершенно разные.

Действительно, в формуле этилового спирта один из шести атомов водорода присоединен к кислородному атому, а в формуле диметилового эфира все шесть водородных атомов связаны с атомами углерода. Да и атом кислорода в одном случае связан с одним углеродным атомом, во втором — находится между двумя углеродными атомами. Поэтому неудивительно, что в различном расположении атомов кроется проявление разных свойств этих соединений. Так, оказалось, что атом кислорода удерживает водородный атом слабее, чем углеродный атом. Поэтому металлический натрий, добавленный к этиловому спирту, легко замещает водород, связанный с атомом кислорода. В то же время натрий, добавленный к диметиловому эфиру, водород не вытесняет. Вот вам еще пример подтверждения теории А. М. Бутлерова: строение молекулы определяет свойства вещества.
Интересный случай изомерии положения у непредельных соединений с двойной связью (алкенов). Например, для соединения С 4Н 8(бутен) возможны три изомера.
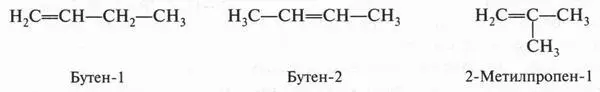
Первые два изомера (с неразветвленной углеродной цепью) отличаются между собой положением двойной связи в цепи, а третий — характером цепи (разветвлением). Таким образом, для алкенов возможны два типа изомерии: изомерия, связанная с положением двойной связи в цепи, и изомерия углеродной цепи (как у алканов). Однако для алкенов возможен еще один вид изомерии — геометрическая ( цис-, транс-) изомерия. Однако этот вид изомерии мы рассмотрим позже, когда подробно рассмотрим строение двойной связи.
Глава 2
Углеродный атом — он самый главный
2.1. В глубь углеродного атома
Атом углерода, как мы уже знаем, — основа всех органических соединений. Он является особым, уникальным элементом в природе.
Как устроен этот атом, какими свойствами он обладает?
Чтобы ответить на этот вопрос, давайте еще раз вспомним о строении атома — этой наименьшей частице химического элемента.
Читать дальшеИнтервал:
Закладка:









