Сэмюел Стернберг - Трещина в мироздании [litres]
- Название:Трещина в мироздании [litres]
- Автор:
- Жанр:
- Издательство:Литагент Corpus
- Год:2019
- Город:Москва
- ISBN:978-5-17-109309-9
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Сэмюел Стернберг - Трещина в мироздании [litres] краткое содержание
Трещина в мироздании [litres] - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Перенос CRISPR из бактериальных клеток в человеческие сработал так, как мы ожидали, но оставался один резонный вопрос: редактирует ли CRISPR ДНК человека?
Мартин и Александра Ист-Селетски, молодая студентка, недавно присоединившаяся к проекту, измельчили еще некоторое количество клеток, выделили из них ДНК и проанализировали состав гена CLTA . Ошибки быть не могло: ген был отредактирован именно на участке, точно совпадающем с последовательностью направляющей РНК. Для неспециалиста результаты не выглядели впечатляющими – какие-то темные полоски на тонкой пластинке гелеподобного материала, – однако выводы из этих “полосок” и потенциальные применения этих выводов имели грандиозное значение.
Всего в несколько простых и хорошо отработанных стадий мы с Мартином выбрали произвольную последовательность ДНК в состоящем из 3,2 миллиарда “букв” геноме человека, спроектировали вариант CRISPR для ее редактирования и стали наблюдать, как крохотная машинерия выполняла то, на что была запрограммирована, – и не где-нибудь, а в живых человеческих клетках. Своими результатами мы подтвердили работу новой технологии, дающей ученым удивительную способность переписать код жизни с хирургической точностью и поразительной простотой. В мгновение ока CRISPR по своему развитию догнал технологии редактирования генома, исследование и разработка которых шли почти двадцать лет.
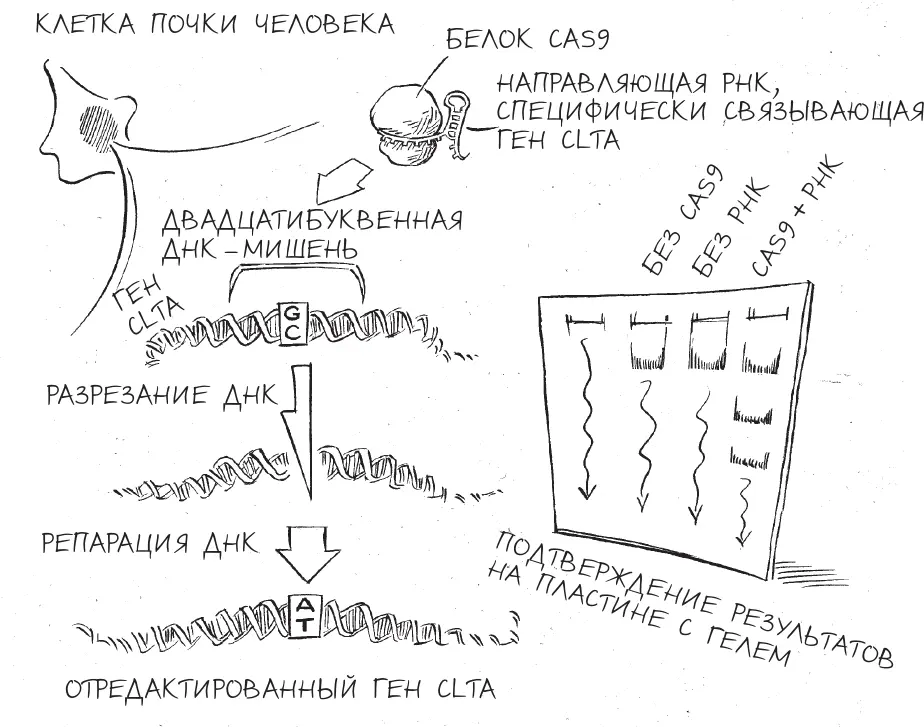
Редактирование ДНК в человеческих клетках c помощью CRISPR
Фактически в такой же спешке, как и шестью месяцами ранее, когда мы готовили публикацию с Кшиштофом и Эммануэль, мы написали текст научной статьи с изложением наших новейших результатов. Если наша первая публикация 2012 года содержала прямое указание на то, что CRISPR следует применить в качестве новой платформы редактирования генома в клетках, то во второй статье уже содержались четкие демонстрация и подтверждение внушительных возможностей этой недавно открытой системы.
Когда 2012-й подходил к концу, я ощущала заметную иронию, читая, что журнал Science , опубликовавший нашу статью о CRISPR всего за полгода до этого, поставил редактирование генома на вторую строчку списка прорывов года (первое место отдали бозону Хиггса), но упомянул в этом пункте более старую технологию, TALEN, открытую непосредственно перед началом нашей работы с CRISPR. Мне было интересно, какие еще сюрпризы CRISPR преподнесет научному сообществу.
К моему глубокому удовлетворению, первые две недели 2013 года ознаменовались публикацией еще пяти научных статей о CRISPR (не считая нашей) [82] L. Cong et al., “Multiplex Genome Engineering Using CRISPR/Cas Systems”, Science 339 (2013): 819–823; P. Mali et al., “RNA-guided Human Genome Engineering via Cas9”, Science 339 (2013): 823–826; M. Jinek et al., “RNA-programmed Genome Editing in Human Cells”, eLife 2 (2013): e00471; W. Y. Hwang et al., “Efficient Genome Editing in Zebrafish Using a CRISPR-Cas System”, Nature Biotechnology 31 (2013): 227–229; S. W. Cho, S. Kim, J. M. Kim and J.-S. Kim, “Targeted Genome Engineering in Human Cells with the Cas9 RNA-guided Endonuclease”, Nature Biotechnology 31 (2013): 230–232; W. Jiang et al., “RNA-guided Editing of Bacterial Genomes Using CRISPR-Cas Systems”, Nature Biotechnology 31 (2013): 233–239.
, и все они описывали сходные эксперименты, в которых эту систему применяли для редактирования генов непосредственно в клетках – как мы и предсказали в 2012-м. И профессор МТИ Фэн Чжан, и гарвардский профессор Джордж Чёрч предварительно связывались со мной, чтобы сообщить о готовящихся публикациях. Статьи Чжана и Чёрча появились на сайте журнала Science в начале января, а чуть позже в том же месяце вышли и наша с Мартином статья, и три другие за авторством профессора Джин Су Кима из Сеульского национального университета, профессора Рокфеллеровского университета Лучано Марраффини и профессора Гарвардской медицинской школы Кита Джоунга.
Это было бурное время. Меня окрыляло то, что наша с Эммануэль работа, опубликованная предыдущим летом, вдохновила других ученых на проведение серий экспериментов, подобных нашим. Лишь позднéе содержание этих статей и даты их публикации начали скрупулезно разбирать и сопоставлять для обоснования той или иной позиции в патентных спорах о CRISPR – досадный поворот событий в истории, которая начиналась как сотрудничество исследовательских коллективов, в атмосфере неподдельного общего восторга по поводу того, что смогут дать человечеству наши исследования!
Сравнив все шесть статей, я осознала, что суммарно в этих экспериментах было отредактировано больше дюжины разных генов. Еще больше радовало разнообразие типов клеток, подвергшихся редактированию. Вдобавок к редактированию генома клеток эмбриональной человеческой почки механизм CRISPR был запрограммирован на то, чтобы разрезать ДНК в клетках человека, пораженных лейкемией, стволовых клетках человека, клетках нейробластомы мыши, бактериальных клетках и даже одноклеточных эмбрионах данио-рерио, популярного модельного организма для генетических исследований. CRISPR не просто демонстрировал отдельные признаки успешного применения; он показывал невероятную гибкость в использовании. Казалось, что любой ген можно сделать мишенью CRISPR, разрезать его и отредактировать, если в клетке присутствует белок Cas9, а направляющая РНК имеет участок, комплементарный двадцатибуквенному коду ДНК.
Ажиотаж вокруг CRISPR усилился в мае, когда лаборатория Рудольфа Йениша в МТИ сообщила о создании мышей с геномом, отредактированным с помощью CRISPR [83] H. Wang et al., “One-Step Generation of Mice Carrying Mutations in Multiple Genes by CRISPR/Cas-Mediated Genome Engineering”, Cell 153 (2013): 910–918.
. Всего шестью годами ранее Нобелевскую премию по физиологии или медицине присудили нескольким ученым за разработку методов внедрения изменений в геном мышей – наиболее популярных модельных животных в изучении генетики млекопитающих. Более двадцати лет этот эффективный, но трудоемкий метод был наилучшим – и фактически единственным – способом воспроизведения в организмах мышей мутаций, вызывающих рак или другие болезни у человека. В 1974-м Йениш стал первым, кто создал трансгенную мышь, чьи клетки содержали чужеродный генетический материал, а пятнадцатью годами спустя он вновь вызвал сенсацию, одним из первых применив этот метод, удостоенный Нобелевской премии. А сейчас успех Йениша с CRISPR привлек внимание к новой технологии, которая не просто вытеснила старый подход, но и давала возможность без сучка и задоринки редактировать геномы других животных.
Предыдущий метод редактирования генома нуждался в эмбриональных стволовых клетках, масштабном обратном скрещивании [84] Скрещивание потомков с представителями родительского поколения.
, скрещивании различных линий животных и во множестве поколений мышей; нередко главным результатом какой-нибудь кандидатской диссертации становилось создание и описание всего одной линии генетически модифицированных мышей. Аналогичных результатов команда Йениша, используя CRISPR, достигла всего за месяц, применив простой четкий протокол – микроинъекции компонентов CRISPR непосредственно в одноклеточный эмбрион с последующей имплантацией эмбрионов с отредактированными геномами в матку самки. Более того, эти исследователи показали, что для отдельно взятого CRISPR не обязательно программировать только одну направляющую РНК; их может быть много, и тогда они способны нацеливать Cas9 на разрезание и одновременное редактирование нескольких последовательностей ДНК в эмбрионах мышей. Такой вариант одноступенчатого множественного редактирования генов раньше никогда не применяли на мышах.
Интервал:
Закладка:
![Обложка книги Сэмюел Стернберг - Трещина в мироздании [litres]](/books/1076035/semyuel-sternberg-trechina-v-mirozdanii-litres.webp)




![Григорий Кузнецов - Руны. Ключи к энергии мироздания [litres]](/books/1057031/grigorij-kuznecov-runy-klyuchi-k-energii-mirozdaniya.webp)
![Сэмюел Сайкс - Семь клинков во мраке [litres]](/books/1057593/semyuel-sajks-sem-klinkov-vo-mrake-litres.webp)
![Сэмюел Сайкс - Десять железных стрел [litres]](/books/1143629/semyuel-sajks-desyat-zheleznyh-strel-litres.webp)
