Чарльз Эллис - Эпигенетика
- Название:Эпигенетика
- Автор:
- Жанр:
- Издательство:Техносфера
- Год:2010
- Город:Москва
- ISBN:978-5-94836-257-1
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Чарльз Эллис - Эпигенетика краткое содержание
Книга ярко и наглядно повествует о новой науке общебиологического значения — эпигенетике, а также об ее отдельных областях. В издании представлено описание разных эпигенетических сигналов и механизмов их реализации, а также собственно феномен, история и концепции эпигенетики, ее отдельные механизмы и пути реализации эпигенетических сигналов в клетке. Авторы различных глав данной книги — ведущие в мире специалисты в области эпигенетики, являющиеся, как правило, и основоположниками ее отдельных областей.
Издание будет полезно широкому кругу читателей, интересующихся коренными проблемами живого мира, сущности жизни и молекулярных механизмов ее проявления.
По формирующейся традиции современной российской научной литературы, оригинальное русскоязычное печатное издание неопрятно переведено, отвратительно вычитано и содержит большое количество ошибок, начиная с обложки. Чарльз Дэвид Эллис указан как С. Д. Эллис.
Эпигенетика - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Транскрипция с обеих нитей ДНК прицентромерных районов у S. pombe и выявление прошедших процессинг дериватов siRNAs явились сильным доказательством того, что дериват dsRNA был важнейшим субстратом для «нацеливания» комплекса RITS на центромеры для сайленсинга (рис. 3.14) (Verdel et al., 2004). Более того, мутанты clr4 (имеющийся у S. pombe ортолог Suv39h HKMT млекопитающих) были не способны процессировать dsRNA до siRNAs, усиливая тем самым доводы в пользу взаимосвязи между механизмом РНКи и сборкой гетерохроматина (Motamedi et al., 2004). Каким именно образом siRNAs, генерируемые механизмом RNAi (т. е. Dicer, Argonaute, RdRP), инициируют сборку гетерохроматина или направляют ее на соответствующие локусы в геноме, все еще неизвестно Была предложена модель, в которой сложное взаимодействие между входящим в состав механизма RNAi комплексом RITS и центромерными повторами ведет к самоусиливающемуся циклу формирования гетерохроматина, включающему Clr4, HDACs, Swi6 (ортолог НР1 млекопитающих) и когезин, вероятно через направляемый Ago отжиг гибридов РНК: РНК до образующегося транскрипта (рис. 3.14) (главы 6 и 8).
У Tetrahymena аналогичный механизм «нацеливания», опосредованного РНК, направляет уникальный процесс элиминации ДНК в соматическом ядре. В этом случае на соответствующей стадии полового процесса происходит, с обеих нитей, транскрипция внутреннего элиминируемого сегмента (IES — internal eliminated segment) в «молчащем» геноме зародышевого пути (микронуклеарном геноме) (Chalker and Yao, 2001; Mochizuki et al., 2002). Аналогично модели TGS, зависимого от RNAi, была предложена модель сканирующей РНК (scnRNA) для объяснения того, как нуклеотидные последовательности ДНК в родительском макронуклеусе могут эпигенетически контролировать геномные изменения в новом макронуклеусе с участием малых РНК (детали см. в главе 7). Эти волнующие результаты впервые демонстрируют RNAi-подобный процесс, непосредственно изменяющий соматический геном. Возникает любопытная возможность, что межгенные РНК, продуцируемые в локусе V-DJ (Bolland et al., 2004), потенциально могут направлять элиминацию нуклеотидной последовательности ДНК в ходе V-DJ-рекомбинации локуса тяжелой цепи иммуноглобулина (IgH) в В-клетках и локусов Т-клеточного рецептора (TCR) в Т-клетках.
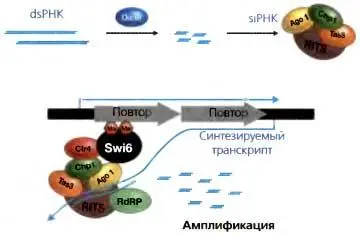
Рис. 3.14.Направляемое РНК формирование гетерохроматина
Комплементарные транскрипты dsRNA, получающиеся путем транскрипции обеих нитей ДНК или складывания на себя транскриптов с инвертированных повторов, приводят к образованию siRNAs благодаря действию Dicer (верхняя часть рисунка). Включение этих siRNAs в комплекс RITS посредством связывания с белком Argonaute (Ago) активирует этот комплекс к «нацеливанию» его на комплементарную ДНК или вновь образующуюся РНК. Этот комплекс привлекает Clr4. который трансдуцирует гистон H3K9me2. Специфичный для этой модификации «связыватель», Swi6, связывается с этими модифицированными гистонами, облегчая распространение репрессивного хроматинового домена. Действие RdRP амплифицирует уровни содержания siRNAs, используя существующие siRNAs в качестве праймеров и усиливая тем самым способность комплекса RITS «нацеливаться» на специфические участки ДНК
У растений имеется ряд ортологов для многих компонентов RNAi, обусловливающих разнообразие путей РНК-сайленсинга, которые могут действовать с большей специфичностью по отношению к конкретным нуклеотидным последовательностям ДНК, хотя имеет место некоторая избыточность между факторами. Исследования TGS, опосредованного RNAi, выявили новый класс РНК-полимераз — РНК-полимеразу IV (или RNA pol IV), — которые могут транскрибировать ДНК исключительно в гетерохроматиновых районах (Herr et al., 2005; Pontier et al., 2005). Опять-таки только для растений характерно, что пути RNAi непосредственно влияют на метилирование ДНК (Chan et al., 2004) (детальные объяснения в главе 9).
RNAi-подобные хроматиновые эффекты были также обнаружены у Drosophila и млекопитающих. Например, обработка пермеабилизированных клеток млекопитающих РНКазой А быстро удаляет гетерохроматиновые метки H3К9me3, что позволяет предполагать, что часть молекул РНК могут быть структурным компонентом околоцентромерного гетерохроматина (Maison et al., 2002). У позвоночных удаление факторов, процессирующих siRNA, нарушает метилирование H3К9 и связывание НР1 в перицентромерном гетерохроматине (Fukugawa et al., 2004). Любопытно, что у мутантов, лишенных Dicer, эмбриональные стволовые (ES) клетки все еще пролиферируют, но не могут дифференцироваться (Kanellopoulou et al., 2005), что заставляет предположить существование сегодня еще непонятной связи между механизмом RNAi и развитием млекопитающих. У Drosophila сайленсинг тандемных наборов гена mini-white, подверженных PEV, также оказывается зависимым от механизма RNAi (Pal-Bhadra et al., 2004).
В совокупности эти исследования указывают на ключевую и, вероятно, первичную роль некодирующих РНК в переключении эпигенетических переходов и наследственно поддерживаемых специфических состояний хроматина хроматиновой матрицы. В самом деле, эти некодирующие РНК дали ответ на вопрос о том, как различные повторяющиеся последовательности у разных организмов достигают состояния гетерохроматинизации посредством механизма, «нацеливаемого» с помощью РНК. Стремясь идентифицировать новые мишени для RNAi, обнаружили, путем секвенирования малых РНК, что у растений, Drosophila , млекопитающих и других организмов они в основном транскрибируются с эндогенных транспозонов и других повторяющихся последовательностей (Almeida and Allshire, 2005; Bernstein and Allis, 2005). В совокупности эти результаты показывают, что RNAi эволюировала, отчасти, в целях поддержания стабильности геномов посредством сайленсирующих мобильных элементов ДНК и вирусов и у большинства эукариотических видов представляет собою консервативный механизм. Сейчас, однако, оказывается, что не только РНК-сайленсинг репрессирует инвазивные последовательности, но что, кроме того, этот базовый механизм был использован клеткой для гетерохроматинизации центромер, обеспечивая тем самым корректное расхождение хромосом и целостность генома.
Все приведенные выше примеры показывают удивительное изменение центральной догмы контроля генов, формулировка которого начинает выглядеть следующим образом: ДНК → некодирующие РНК → хроматин → функция гена . Никто не предвидел появление представлений о том, что некодирующие РНК активно участвуют в работе RNAi-подобных механизмов, которые также «нацеливают» локус-специфичные домены на ремоделинг хроматина и сайленсинг генов.
11. От одноклеточных систем к многоклеточным
5000–6000 генов, содержащихся в геномах почкующихся и дробянковых дрожжей, достаточны для регуляции основных метаболических процессов и процессов клеточного деления. Здесь, однако, нет потребности в клеточной дифференпировке, поскольку эти одноклеточные организмы в основе своей являются клональными и, как таковые, многократно повторяющимися «бессмертными» существами. В противоположность им млекопитающие кодируются приблизительно 25000 генами, требующимися в клетках примерно 200 разных типов. Понимание того, каким образом с одной и той же генетической матрицы генерируется и координируется связанная с многоклеточностью сложность организма, является ключевым вопросом в эпигенетических исследованиях.
Читать дальшеИнтервал:
Закладка: