Роберт Сапольски - Биология добра и зла. Как наука объясняет наши поступки
- Название:Биология добра и зла. Как наука объясняет наши поступки
- Автор:
- Жанр:
- Издательство:Альпина нон-фикшн
- Год:2019
- Город:Москва
- ISBN:978-5-0013-9051-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Роберт Сапольски - Биология добра и зла. Как наука объясняет наши поступки краткое содержание
Биология добра и зла. Как наука объясняет наши поступки - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Среди приверженцев концепции синцития нейронная доктрина считалась полнейшей глупостью. «Покажите нам эти пресловутые промежутки, – требовали они от еретиков. – И скажите, как возбуждение перепрыгивает от одного нейрона к другому».
Но вот в 1873 г. трудами итальянского нейробиолога Камилло Гольджи все разрешилось. Он изобрел новый метод окраски нервных тканей мозга. А упомянутый выше Кахаль этим «методом по Гольджи» прокрасил у одного из нейронов каждый отросток, каждую веточку и сучочек, каждый шипик. И что важно, краска не перетекала от одного нейрона в другой. Значит, нет никакой непрерывной, слитой воедино супернейронной сети. А есть самостоятельные дискретные клетки. Адепты нейронной доктрины взяли верх над синцитщиками [533].
Справились, молодцы! Дело закрыто. Действительно между аксонными окончаниями и дендритными шипиками существуют микрощелочки. Они получили название «синапсы» (до тех пор, пока в 1950-х гг. не был изобретен электронный микроскоп, сами щелочки разглядеть не получалось, так что последний гвоздь в гроб синцитщиков был забит не сразу). Но если это правда, как же сигнал возбуждения переходит от одного нейрона к другому, как он перепрыгивает через синапс?
Он и не перепрыгивает, хотя именно так считали всю первую половину XX столетия, просто электрический сигнал преобразуется в сигнал другого типа.
Нейромедиаторы
На самых кончиках аксонов, привязанные к клеточной мембране, сидят специальные пузырьки, они заполнены молекулами химического передатчика. И вот по аксону от далекого-далекого аксонного холмика бежит потенциал действия. Дойдя до кончика, он запускает процесс высвобождения этих химических передатчиков в щель синапса. Высвободившиеся молекулы плывут через щель и добираются до другого берега – дендритного шипика, возбуждая его. Эти химические передатчики называются нейромедиаторами.
Как же они, будучи выпущены с «пресинаптической» стороны синапса, инициируют сигнал в «постсинаптической» стороне дендритного шипика? На мембране шипика сидят рецепторы нейромедиаторов. О! Самое время познакомиться с одной из величайших биологических метафор! Молекула нейромедиатора имеет определенную трехмерную форму (одну и ту же у всех молекул конкретного нейромедиатора). А рецептор снабжен специальным слотом, куда как влитая вставляется молекула нейромедиатора. Таким образом, нейромедиатор подходит к рецептору – вот она, метафора, – как ключ к замку. Никакая другая молекула не вставится в скважину рецептора, и ни к какому другому рецептору наш нейромедиатор не подойдет [534]. И когда нейромедиатор связывается с рецептором, то каналы открываются, поток ионов устремляется внутрь дендритного шипика, рождая потенциал.
Так описывается «транссинаптическая» передача с участием нейромедиаторов. За исключением одного неясного момента: что дальше происходит с молекулами нейромедиатора – после того как они связались с рецепторами? Они же не остаются в таком положении навсегда – вспомним, что потенциал действия длится порядка миллисекунды. Нейромедиаторы открепляются от рецепторов, и теперь нужно очистить от них пространство синапса. Для этого существует два способа. Вот первый. У заботящихся об экологии синапсов на мембране аксонного окончания работают «насосы обратного захвата». Они подтягивают к себе нейромедиаторы, перерабатывают их и отправляют обратно в пузырьки, откуда те могут вновь вступить в игру [535]. Второй способ – разрушить нейромедиатор, а продукты его распада пусть отправляются в океан (т. е. во внеклеточное пространство, оттуда – в спинномозговую жидкость, а потом в кровоток и в конце концов – в мочевой пузырь).
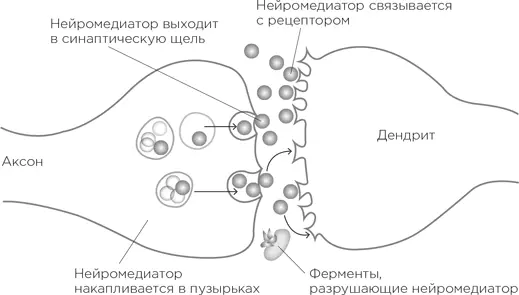
Оба способа ведения нейронного хозяйства чрезвычайно важны. Предположим, нам нужно увеличить количество нейромедиатора в синапсе. То есть, если перевести это в термины возбуждений и потенциалов, используемые в одном из предыдущих параграфов, требуется увеличить возбудимость синапса, чтобы потенциал действия в пресинаптическом нейроне погромче и поскорее отозвался в постсинаптическом; иными словами, чтобы увеличилась вероятность появления потенциала действия во втором нейроне. Можно увеличить количество нейромедиатора, высвобождаемого в синаптическое пространство, – получится погромче. А можно увеличить количество рецепторов на дендритном шипике – и получится более чуткий слух.
Но есть и другая возможность: снизить активность насоса обратного захвата. В результате больше молекул нейромедиатора останется в синапсе. И они дольше будут сидеть на рецепторах или, открепившись от них, будут снова и снова с ними связываться, усиливая сигнал. Или – что в принципе то же самое – можно ослабить активность ферментов, разрушающих нейромедиатор: меньше молекул будет переводиться в нерабочее состояние и больше – оставаться в рабочем. Эффект тот же – усиление сигнала. И, как мы неоднократно видели на страницах этой книги, исследования, связанные с количеством синтезированных и высвобожденных в синапсы нейромедиаторов, количеством и функционированием рецепторов, насосов обратного захвата и ферментов, разрушающих нейромедиаторы, помогают раскрывать интереснейшие индивидуальные различия в нашем поведении.
Типы нейромедиаторов
Что же представляют собой эти мифические молекулы нейромедиаторов, которые под нажимом потенциала действия выпускаются в синаптическое пространство сотнями миллиардов аксонных окончаний? Дело усложняется еще и тем, что существует не один тип нейромедиаторов.
Почему не один? Ведь в каждом синапсе идет единообразный процесс, в ходе которого нейромедиатор связывается с рецептором по принципу «ключ к замку» и тем самым открывает различные каналы; ионы перетекают по ним, и шипик получает чуть менее отрицательный заряд.
Но причины есть. Одна из них заключается в том, что разные нейромедиаторы дают разную длительность и степень деполяризации, т. е. обеспечивают возбуждение разной силы и продолжительности. А значит, появляется возможность усложнить проходящую от нейрона к нейрону информацию.
Вторая причина сразу удвоит поле обзора: есть нейромедиаторы, которые не деполяризуют шипики и не увеличивают вероятность появления потенциала действия в следующем нейроне, а делают все наоборот. Они как раз гиперполяризуют дендритный шипик, открывая для этого другие типы каналов и еще больше сдвигая потенциал покоя в отрицательную сторону (от –70 к –80 мВ). Перед нами т. н. тормозные нейромедиаторы или ингибиторы . Теперь понятно, как усложнились наши модели – мало того, что нейрон с 10 000 дендритных шипиков получает сигналы возбуждения различной силы от разных нейронов, так ведь при этом от других он получает сигналы торможения… И все это обрабатывается в бухгалтерии аксонного холмика.
Читать дальшеИнтервал:
Закладка:





![Роберт Сапольски - Игры тестостерона и другие вопросы биологии поведения [litres]](/books/1074102/robert-sapolski-igry-testosterona-i-drugie-vopros.webp)




