Ирина Мальцева - Эпигенетика. Управляй своими генами
- Название:Эпигенетика. Управляй своими генами
- Автор:
- Жанр:
- Издательство:Издательство АСТ
- Год:2021
- Город:М.
- ISBN:978-5-17-123203-0
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ирина Мальцева - Эпигенетика. Управляй своими генами краткое содержание
Можно ли «обезвредить» переданные прабабушкой еще в молодости риски диабета, сердечно-сосудистых заболеваний? Как не «наградить» своих детей и внуков ожирением и депрессией? Как защитить себя от рака, находясь в зоне риска?
Авторы помогают разобраться в том, как влияет эпигенетика на повышение рисков распространенных хронических болезней цивилизации, а также как подготовиться к рождению здорового малыша.
Благодаря прочтению этой книги вы получите практические рекомендации в области питания и изменения образа жизни – у вас появится мощный инструмент управления своим здоровьем. Помните – от нас самих зависит очень многое.
Эпигенетика. Управляй своими генами - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Транспозиция генов – перемещения небольших участков генетического материала по одной хромосоме или между разными хромосомами. Транспозиции происходят при участии подвижных (мобильных) генетических элементов – транспозонов.
Дискриминация и репрессия генов – механизмы регуляции действия генов, заключающиеся в подавлении транскрипции или трансляции путем связывания белка-репрессора (кодируемого геном-регулятором) с оператором в ДНК либо специфическим участком матричной РНК (мРНК).
Митоз – непрямое деление клетки, наиболее распространенный способ репродукции эукариотических клеток. Биологическое значение митоза состоит в строго одинаковом распределении хромосом между дочерними ядрами, что обеспечивает образование генетически идентичных дочерних клеток и сохраняет преемственность в ряду клеточных поколений. Неполовые (соматические) клетки человека делятся митозом, а половые (гаметы) – мейозом.
Метилирование в промоторной зоне гена, как правило, приводит к подавлению активности (экспрессии) соответствующего гена. Метилированный цитозин может затем окисляться с помощью особых ферментов, что в конечном итоге приводит к его деметилированиюобратно в цитозин.
В ДНК существуют так называемые островки CpG, то есть эти соединения Ц-Г не единичны, а многочисленны и расположены рядом в виде скоплений.
Особенно ими богаты промоторы, очень важные для регуляции активности гена участки. Метилирование промоторных участков генов представляет собой процесс, как будто на эти участки поставили специальные метки. Кстати, они так и называются – метильные метки. Это сопровождается торможением/снижением активности/экспрессии генов из-за того, что в результате метилирования СрG-пар меняется связывание с ДНК различных факторов, участвующих в процессе транскрипции. Некоторые из них являются гормон-рецепторными комплексами. Другими словами, существует связь между гормональными регуляторами, которые участвуют в различных реакциях организма на внешние изменения, и эпигеномом, способным быстро реагировать на изменения и требования среды.
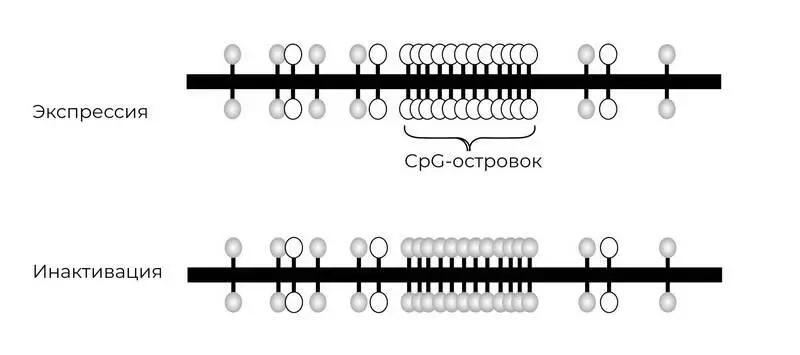
Рис. 13. Островки СрG
Метилирование имеет важное значение, так как не все гены активны постоянно. Большинство из них являются подавленными. Метилирование является эпигенетическим средством сохранения генов, например, гиперметилирование подавляет активность генов до тех пор, пока они не понадобятся. Цель эпигенетической терапии состоит в том, чтобы создать условия для оптимального метилирования, а не повышенного или сниженного.
Сейчас продается много различных «модных» метилированных витаминов в основном западного происхождения. С одной стороны, существуют особые состояния (полиморфизмы) генов, которые не способствуют усвоению, например, цианокобаламина (форма витамина B 12), так же эффективно, как метилкобаламина (метильная форма витамина B 12). Хотя метильная форма витамина B 12имеет большую биодоступность, но если этими витаминами переборщить, то избыточное их потребление может иметь неблагоприятное эпигенетическое последствие.
В детстве многие любили книгу «Остров сокровищ», где был эпизод, когда пирату принесли черную метку. Наверняка при прочтении возникло чувство тревоги, предчувствие чего-то очень опасного, пусть даже не для самого положительного героя книги. Когда человек подвергается негативным влияниям среды, включая не только некачественную еду, токсины, радиацию, но и стрессовую нагрузку от негативных мыслей (мыслей-«тараканов»), то ему как бы приносят «черную метку эпигенетики». Черная метка – это угроза, которую нельзя игнорировать. Есть ли возможности эту метку уничтожить? Об этом чуть позже.
На самом деле не все метильные метки «черные». «Черными» они становятся тогда, когда угрожают здоровью. На самом деле они нейтральные, или просто метки. В норме у млекопитающих и человека в том числе метилировано около 60–70 % всех CpG-динуклеотидов, то есть на них стоят метки (-СН 3). Неметилированные CpG-динуклеотиды сгруппированы в CpG-островки, которые присутствуют в 5'-регуляторных областях многих генов. Различные заболевания, например рак, сопровождаются начальным ненормальным снижением метилирования – гипометилированием ДНКи последующим сверхактивным метилированием – гиперметилированием CpG-островковв промоторных областях генов, что приводит к устойчивому угнетению процесса транскрипции.
Метилирование ДНК происходит при помощи ферментов ДНК-метилтрансфераз( DNMT, англ.). Они принадлежат к некоторым семействам – 1, 2, 3.
Наиболее изученным на сегодня ферментом системы метилирования ДНК у позвоночных является ДНК-метилтрансфераза 1 (DNMT1), которая поддерживает метилированное состояние ДНК, присоединяя метильные группы к одной из цепей ДНК в точках, где другая, комплементарная ей цепь, метилирована.
ДНК-метилтрансфераза 3 семейства DNMT3 (DNMT3A и DNMT3B), экспрессия которой координируется белком DNMT3L (Gowheretal.,2005), лимфоидспецифичной геликазой Lsh (Zhu et al., 2006), микроРНК (Fabbri et al., 2007) и piРНК (Aravin et al., 2008), осуществляет метилирование de novo(de novo-метилирование осуществляет модификацию прежде неметилированных последовательностей ДНК), а функции ДНК-метилтрансферазы 2 до сих пор до конца не изучены.
Хроматин. Ковалентные модификации ядерных белков (гистонов), входящих в состав хроматина
Другим механизмом эпигенетической регуляции является ковалентная модификация ядерных белков-гистонов. В настоящее время известны различные виды модификаций:
• метилирование;
• фосфорилирование;
• рибозилирование;
• убиквитинирование;
• ацетилирование.
Все они происходят в посттранскрипционной фазе и главным образом в аминокислотных остатках лизина, аргинина и треонина. Данные биохимические процессы катализируются и регулируются соответствующими ферментами и гормонами.
К каждому остатку лизина может присоединяться до трех метильных групп, в результате чего лизин может быть монометилированным, диметилированным или триметилированным. Аргинины, в отличие от лизинов, могут быть только моно– и диметилированными.
Ацетилирование гистонов связано с добавлением ацильной группы (-COCH 3) к лизину ацетилтрансферазами, в то время как деацетилирование заключается в удалении ацильной группы деацетилазами. Ацетилирование лизина связано с активацией транскрипции.
Механизм изменения генной активности связан с модификацией упаковки ДНК в нуклеосомах, то есть степени ее прилегания к белковым субъединицам. Соответственно, от насыщенности гистоновых мономеров остатками фосфорной или уксусной кислоты, рибозы или небольшого консервативного белка убиквитина зависит степень «компактности» упаковки ДНК, от которой, в свою очередь, зависит степень вероятности транскрипции определенных участков генома. Этот процесс осуществляется широким набором соответствующих ферментов, также регулируемых гормонами. В данном случае механизм изменения активности генов связан с модификацией упаковки ДНК в нуклеосомах, то есть степенью ее прилегания к белковым субъединицам.
Читать дальшеИнтервал:
Закладка:










