Михаил Ермолаев - Биологическая химия
- Название:Биологическая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1974
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Ермолаев - Биологическая химия краткое содержание
В учебнике нашли отражение последние научные данные о ферментах, белках, гормонах, обмене веществ и энергии и т. д. Особое внимание обращено на значение и использование данных биохимии в медицине, в связи с чем расширены разделы, посвященные патологии разных видов обменов и их исследованиям в клинике Включены материалы по наследственным заболеваниям, связанным с нарушением синтеза белка и ферментов.
Учебник написан по программе, утвержденной Министерством здраво" хранения СССР, и предназначен для учащихся фельдшерско-лаборантских отделениях медицинских училищ.
Биологическая химия - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:

Таблица 6. Потребность в белках
Азотистый баланс
Так как белки представляют собой азотсодержащие вещества, одним из методов, характеризующих состояние белкового обмена в организме и биологическую ценность продуктов питания, является определение баланса азота. Баланс азота — это разница между количеством азота, поступившего в организм, и азота, выведенного из него. Обычно у здорового человека при нормальном белковом питании имеется состояние белкового равновесия, когда поступление азота полностью покрывает его расход. При отрицательном балансе азота выводится больше, чем поступает. Такое состояние может наблюдаться при белковом голодании, нарушениях деятельности пищеварительного аппарата, рвоте и т. д. Положительный азотистый баланс наблюдается в тех случаях, когда азота вводится больше, чем выводится. Это бывает при беременности, у растущего организма, при бурном росте опухоли и других состояниях, когда в организме повышены процессы биосинтеза белка.
Биологическая ценность белка
Азотистый баланс только частично может характеризовать биологическую ценность пищи и обеспеченность организма белками. Как известно, для синтеза белков организма необходимы различные аминокислоты. Ряд из них может синтезироваться в организме. Такие аминокислоты называются заменимыми. Те же, которые не синтезируются и должны поступать с пищей, называются незаменимыми.
К заменимым аминокислотам относятся глицин, аланин, серии, глютаминовая кислота, аспарагиновая кислота, тирозин, аргинин, пролин и гистидин [5] Гистидин является незаменимой аминокислотой только для детей.
.
Незаменимыми аминокислотами являются треонин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан и лизин.
Только те белки пищи, которые имеют в своем составе все незаменимые аминокислоты, считаются полноценными. В случае отсутствия одной или нескольких незаменимых ами- .. нокислот белки являются неполноценными. Однако такое определение полноценных и неполноценных белков в настоящее время недостаточно. Это связано с тем, что использование организмом аминокислот пищи зависит еще и от соотношений последних между собой. Потребности организма будут полностью обеспечены только в том случае, если соотношение незаменимых аминокислот в пище будет примерно таким же, как и в самом организме.
Таким образом, полноценными белками можно считать только такие, которые имеют в своем составе набор всех незаменимых аминокислот в соотношениях, приближающихся к таковым в организме. На этом основании А. А. Покровским рассчитана суточная потребность человека в незаменимых аминокислотах.
Потребность взрослого человека в триптофане составляет 1,0 г , в треонине — 2-3 г , в лизине — 3,5 г, в метионине — 2,4 г, в фенилаланине — 2-4 г , в валине — 4,0 г , в лейцине — 4,6 г, в изолейцине — 3-4 г.
Среди белков пищевых продуктов, однако, практически нет ни одного, который бы отвечал таким требованиям. С некоторым приближением к полноценным белкам можно отнести белки материнского молока, куриного яйца, икры рыб, мозга животных. Поэтому для полного обеспечения здорового организма полноценными белками в суточный рацион человека должны входить белки различных пищевых продуктов. При различных патологических состояниях потребность в белках может меняться. Так, например, при заболеваниях желудочно-кишечного тракта могут нарушаться процессы переваривания и всасывания белков, что влечет за собой изменение и белкового состава рациона. При других заболеваниях может снижаться уровень заменимых аминокислот. В этих случаях они становятся незаменимыми и должны поступать с пищей.
Белковые резервы организма
Было установлено, что чем больше с пищей поступает белка, тем больше выделяется из организма конечных продуктов белкового обмена, так как белки не откладываются про запас в отличие от углеводов и жиров. Однако при голодании или длительной белковой недостаточности в течение определенного времени в организме поддерживается состояние белкового равновесия. Изучение этого вопроса позволило Б. И. Словцову впервые высказать мнение о том, что в организме существуют какие-то белковые резервы, которые используются в первую очередь при белковом голодании. Это послужило основанием для детального изучения наличия таких запасов в организме и путей их расходования. При этом было установлено, что при недостаточном поступлении белка с пищей относительно уменьшается вес ряда органов и в первую очередь печени и мышц. При определении количества белка установлено, что наиболее снижено содержание белков плазмы, особенно альбуминов, печени и мышц, в меньшей степени белков сердца и головного мозга.
Потеря 1 г белков плазмы сопровождается потерей 30 г белков организма.
По данным Аллисон, при голодании количество белка в печени может снизиться до 53%, а в сердце — до 48% по сравнению с нормальным уровнем. Это позволяет говорить о наличии в организме определенных белковых резервов, которые используются при неблагоприятных условиях для поддержания деятельности жизненно важных процессов.
При полноценном питании происходит восстановление уровня белка в организме до нормы.
Переваривание белков в пищеварительном тракте
В полости рта отсутствуют протеолитические ферменты, и поэтому белки здесь не расщепляются.
Основная масса белков распадается в желудке под действием желудочного сока, которого в сутки выделяется около 2,5 л. В его составе содержится соляная кислота, которая вырабатывается обкладочными клетками слизистой оболочки желудка и способствует набуханию белков (денатурации), облегчая тем самым гидролитическое расщепление их ферментами.
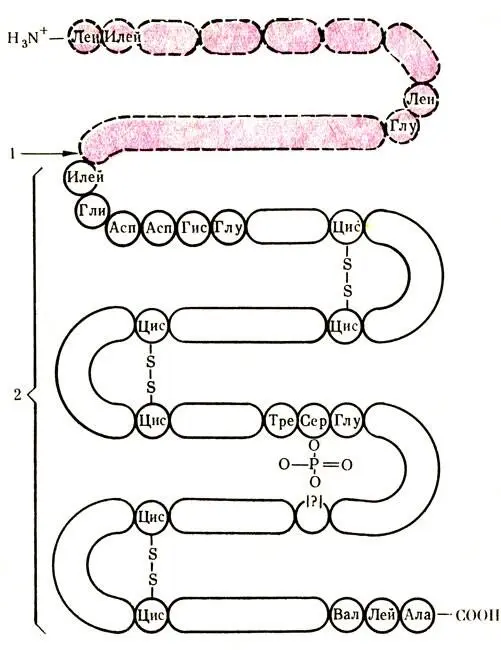
Рис. 58. Структура пепсиногена. 1 — место отщепления полипептида от молекулы пепсиногена; 2 — активный пепсин
Основным протеолитическим ферментом желудочного сока является пепсин , который образуется из профермента (неактивного фермента) пепсиногена, секретируемого главными клетками слизистой оболочки желудка. Превращение пепсиногена в пепсин может происходить двумя путями: под влиянием соляной кислоты или путем аутоак-тивации. Механизм их действия одинаков. Как соляная кислота, так и имеющийся в желудочном соке пепсин отщепляют от пепсиногена полипептид с молекулярным весом 7000. При этом происходит определенная внутримолекулярная перестройка молекулы, в результате чего образуется активный пепсин, схема которого показана на рис. 58. За сутки в желудке вырабатывается около 2 г пепсина. Каталитическая активность пепсина при рН среды желудка очень высока. Пепсин катализирует расщепление пептидных связей в молекуле белка, который распадается на отдельные аминокислоты и гюлипептиды различной величины. По последним научным данным, пепсин катализирует разрыв пептидных связей, образованных, главным образом, ароматическими и дикарбоновыми аминокислотами.
Читать дальшеИнтервал:
Закладка:









