Михаил Ермолаев - Биологическая химия
- Название:Биологическая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1974
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Ермолаев - Биологическая химия краткое содержание
В учебнике нашли отражение последние научные данные о ферментах, белках, гормонах, обмене веществ и энергии и т. д. Особое внимание обращено на значение и использование данных биохимии в медицине, в связи с чем расширены разделы, посвященные патологии разных видов обменов и их исследованиям в клинике Включены материалы по наследственным заболеваниям, связанным с нарушением синтеза белка и ферментов.
Учебник написан по программе, утвержденной Министерством здраво" хранения СССР, и предназначен для учащихся фельдшерско-лаборантских отделениях медицинских училищ.
Биологическая химия - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:

Синтез и-РНК заключается в том, что молекула ДНК, как имеющая двойную спираль, в определенные моменты раскручивается и на каждой из раскрученных нитей ДНК строится молекула и-РНК по принципу комплементарное™ (рис. 59). Следовательно, каждому азотистому основанию ДНК соответствует комплементарное азотистое основание и-РНК. В результате этого молекула информационной РНК в точности повторяет последовательность азотистых оснований ДНК и, следовательно, генетическую информацию. Молекула и-РНК является матрицей, на которой строится белок, соответствующий данному организму.
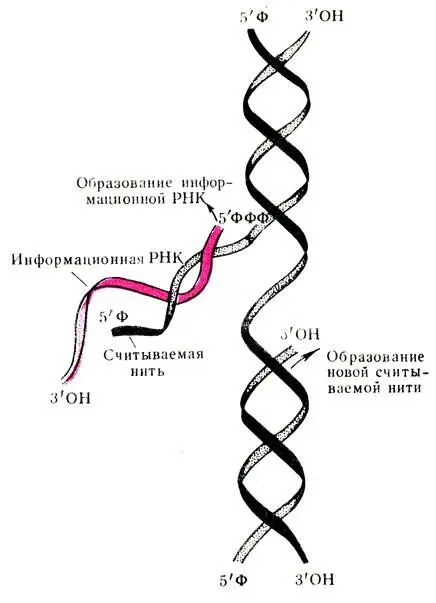
Рис. 59. Образование информационной РНК
Основная функция аминокислот — это участие в биосинтезе белка. Начинается этот процесс с активации аминокислот (при участии АТФ с образованием комплексов — аминоациладенилатов . Для каждой аминокислоты имеется своя определенная транспортная РНК (т-РНК), к которой и присоединяется вполне определенная аминокислота в виде аминоациладенилата. Этот комплекс переносится к рибосомам. Особенностью т-РНК является наличие у нее определенного триплета (антикодона) , комплементарного кодону и-РНК.
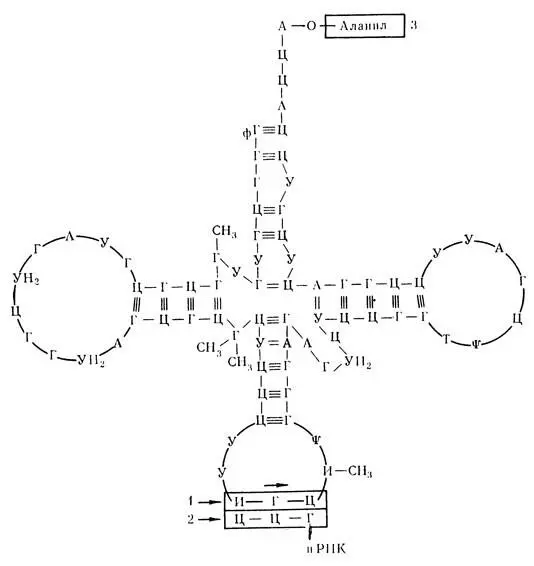
Биосинтез белка заключается на последнем этапе в том, что т-РНК определенной аминокислоты своим антикодом присоединяется к кодону и-РНК. К следующему кодону и-РНК присоединяется антикодон другой т-РНК с новой аминокислотой. Две последовательно расположенные аминокислоты соединяются между собой при помощи пептидной связи . Общая схема биосинтеза белка показана на рис. 60.
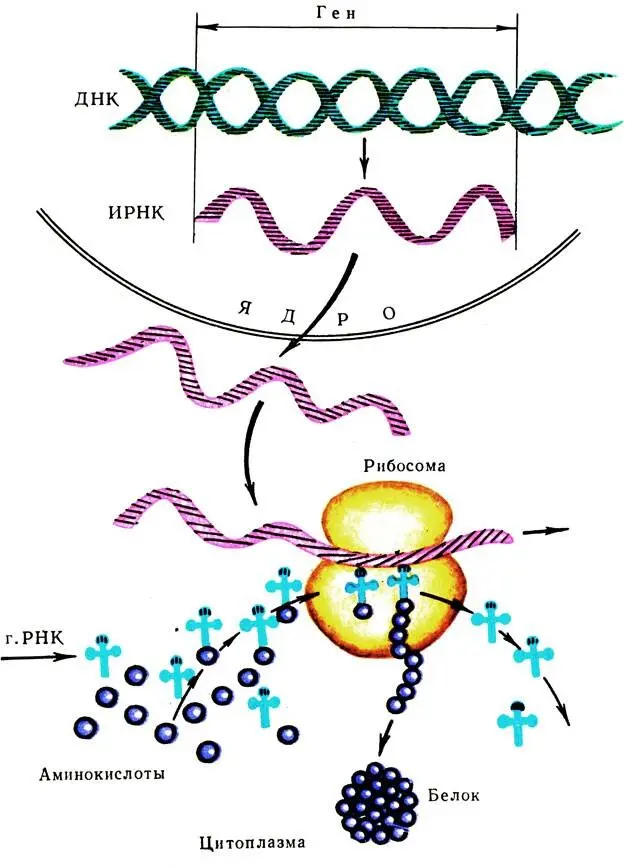
Рис. 60. Схема биосинтеза белка в рибосоме (по А. С Спирину)
Таким путём происходит образование первичной структуры белка. В дальнейшем полипептидная цепь отсоединяется от РНК, закручивается в спираль и, наконец, приобретает специфическое пространственное расположение — третичную структуру .
Процесс биосинтеза белка находится под контролем как механизмов внутри клетки, так и вне ее.
Другие пути превращения аминокислот
Дезаминирование
Этот процесс заключается в расщеплении аминокислот под действием ферментов дезаминаз или оксидаз на аммиак и безазотистый остаток.
Дезаминирование может происходить несколькими путями, которые представлены в виде схем:
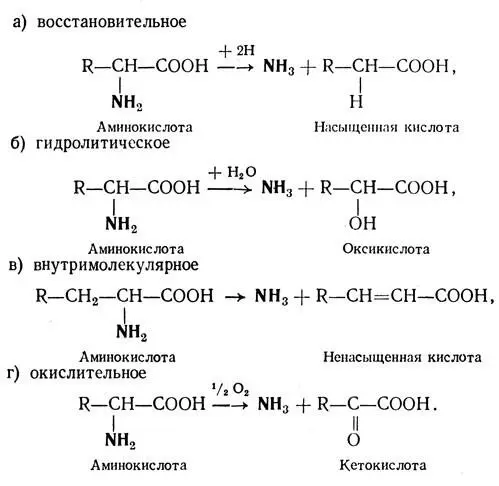
Как установлено, у животных и человека преобладает внутримолекулярное и окислительное дезаминирование. Последний процесс происходит в два этапа через стадию образования иминокислоты:
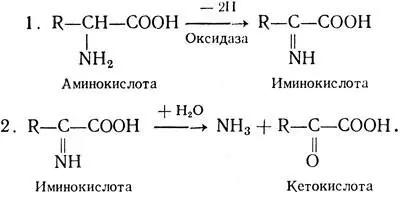
В организме человека наиболее активно протекает дезаминирование глютаминовой кислоты под действием фермента глютаматдегидрогеназы, обнаруженного в митохондриях всех тканей. При этом образуется α-кетоглютаровая кислота, которая принимает участие во многих процессах обмена веществ.
Ферменты, катализирующие процессы дезаминирования, могут катализировать и обратные процессы — аминирования. Синтез аминокислот из кетокислот и аммиака получил название прямого, или восстановительного, аминирования.
Активен процесс аминирования глютаминовой и аспарагиновой аминокислот, когда аммиак присоединяется по месту гидроксила карбоксильной группы с образованием их амидов — глютамина и аспарагина:
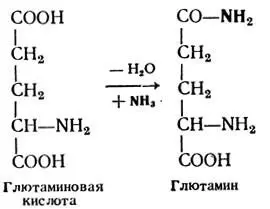
Переаминирование
В 1937 г. отечественными учеными акад. А. Е. Браунштейном и М. Г. Крицман впервые был установлен замечательный факт возможности непосредственного переноса аминной группы от аминокислоты на кетокислоту без освобождения при этом аммиака. Этот процесс протекает по следующей схеме:
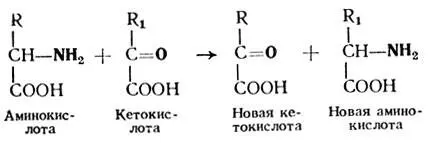
При изучении этого процесса были открыты ферменты, которые катализируют эти превращения. Они относятся к аминотрансферазам. Это сложные ферменты, простетической группой которых является фосфопиридоксаль — фосфорный эфир витамина В 6.

А. Е. Браунштейн
Процесс переаминирования является сложным процессом и протекает в 2 этапа. На первом этапе происходит перенос NH 2-группы с аминокислоты на кофермент аминотрансферазы (фосфопиридоксаль). При этом аминокислота превращается в соответствующую кетокислоту. На втором этапе аминогруппа с кофермента передается на кетокислоту, которая превращается в аминокислоту.
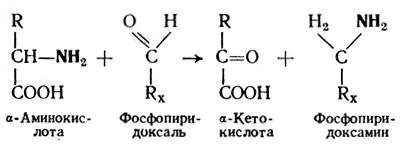
(1)
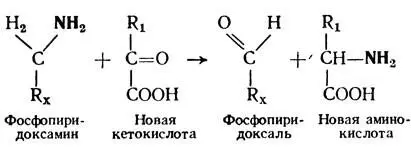
(2)
Процесс переаминирования широко распространен в живой природе. Он имеет первостепенное значение в обмене аминокислот. В процессе переаминирования обязательно участвует одна из двух дикарбоновых аминокислот — глютаминовая или аспарагиновая, которые в виде соответствующих им кетокислот — α-кетоглютаровой и щавелевоуксусной — могут взаимодействовать с большинством аминокислот, за исключением лизина, треонина и аргинина. Особенностью этого процесса является его легкая обратимость.
В обмене веществ реакции переаминирования имеют важное значение, так как от них зависят такие процессы, как:
1. биосинтез многих заменимых аминокислот из соответствующих им кетокислот;
2. распад аминокислот;
3. объединение путей углеводного и аминокислотного обменов, когда из продуктов распада глюкозы, например пировиноградной кислоты, может образоваться аминокислота аланин, и наоборот.
Определение некоторых аминотрансфераз имеет важное значение в клинике. Это относится к определению в сыворотке крови глютамат-щавелевоуксусной и глютамат-пировиноградной аминотрансфераз (ГЩУТ и ГПТ). Первый из этих ферментов обеспечивает синтез аспарагиновой кислоты из щавелевоуксусной за счет NH 2-группы глютаминовой кислоты, а второй — катализирует образование аланина из пировиноградной кислоты.
Читать дальшеИнтервал:
Закладка:









