Михаил Ермолаев - Биологическая химия
- Название:Биологическая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1974
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Ермолаев - Биологическая химия краткое содержание
В учебнике нашли отражение последние научные данные о ферментах, белках, гормонах, обмене веществ и энергии и т. д. Особое внимание обращено на значение и использование данных биохимии в медицине, в связи с чем расширены разделы, посвященные патологии разных видов обменов и их исследованиям в клинике Включены материалы по наследственным заболеваниям, связанным с нарушением синтеза белка и ферментов.
Учебник написан по программе, утвержденной Министерством здраво" хранения СССР, и предназначен для учащихся фельдшерско-лаборантских отделениях медицинских училищ.
Биологическая химия - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Помимо пепсина, в желудке присутствует другой протеолитический фермент гастриксин , оптимум действия которого лежит в пределах рН 2,5-3,5.
В желудке хорошо перевариваются альбумины и глобулины животного и растительного происхождения, плохо расщепляются белки соединительной ткани (коллаген и эластин) и совершенно не расщепляются кератин и протамины.
Образовавшиеся в желудке полипептиды и нерасщдпленные белки поступают в двенадцатиперстную кишку и тонкий кишечник. Здесь они подвергаются воздействию большой группы протеолитических ферментов, вырабатываемых поджелудочной железой и слизистой оболочкой гонкого кишечника.
Сок поджелудочной железы поступает в двенадцатиперстную кишку и тонкий кишечник, где смешивается с кишечным соком. Эта смесь соков содержит протеолитические ферменты, обеспечивающие расщепление белка до аминокислот. К ним относятся трипсин, химотрипсин, карбоксипептидаза, лейцинаминопептидаза и большая группа три- и дипептидаз.
Трипсин и химотрипсин вырабатываются в недеятельном состоянии в виде проферментов — трипсиногена и химотрипсиногена. Процесс их активации заключается в следующем. Трипсиноген под действием фермента энтеро-киназы превращается в трипсин. Г. К. Шлыгин установил, что энтерокиназа сама вырабатывается в недеятельном состоянии в виде кинозогена и активируется ранее образованным трипсином. Трипсиноген, так же как и пепсиноген, может активироваться уже имеющимся трипсином (процесс аутоактивации). Химотрипсиноген под действием трипсина превращается в активный фермент — химотрипсин. Оптимум действия этих ферментов лежит в слабощелочной среде (рН 7,8-8,1). Трипсин расщепляет полипептиды и белки, главным образом пептидные связи между ароматическими аминокислотами и диаминокислотами — аргинином и лизином. Химотрипсин действует на белки и полипептиды, содержащие ароматические аминокислоты, а также на те пептидные связи, на которые трипсин не влияет.
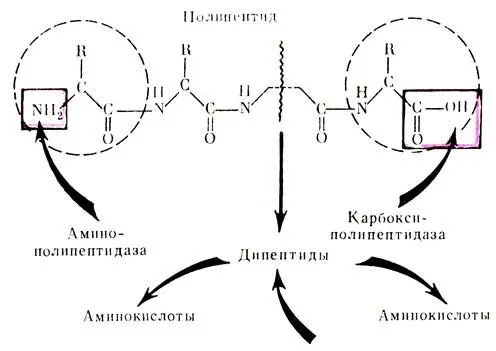
Механизм действия амино- и карбоксиполипептидаз заключается в отщеплении от полипептидов концевых аминокислот, которые имеют соответственно свободную аминную или карбоксильную группу. Оставшиеся нерасщепленными небольшие пептиды, состоящие из 3-4 аминокислотных остатков, подвергаются гидролизу специфическими ди- и трипептидазами. Таким образом, в результате пищеварения в желудке и кишечнике белки в основном расщепляются до аминокислот и небольшого количества пептидов.
Гниение белков в кишечнике под влиянием бактерий
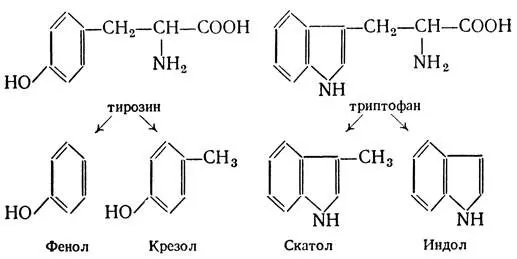
Некоторое количество не всосавшихся в тонком кишечнике аминокислот белков ? поступают в толстый кишечник, где подвергаются воздействию микроорганизмов — гниению, при котором образуются различные вещества, в том числе ядовитые. К последним относятся путресцин и кадаверин, которые образуются при декарбоксилировании орнитина и лизина. Из тирозина образуются фенол и крезол, а из триптофана — скатол и индол.
Продукты гниения белков всасываются в кровь воротной вены, откуда попадают в печень, где обезвреживаются, вступая в соединение с активными формами серной или глюкуроновой кислот по следующей схеме:
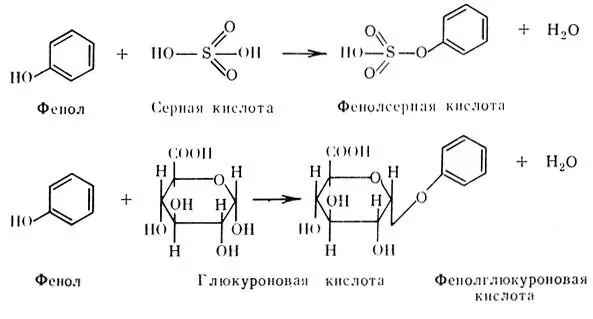
Калиевая соль индоксилсерной кислоты называется животным индиканом и выделяется в значительных количествах при атонии кишечника, хронических запорах, заворотах, т. е. при длительной задержке продуктов переваривания пищи в кишечнике.
Некоторые ядовитые вещества, например бензойная кислота, обезвреживаются в печени путем образования с аминокислотой глицином гиппуровой кислоты, безвредного соединения, которое выделяется с мочой.
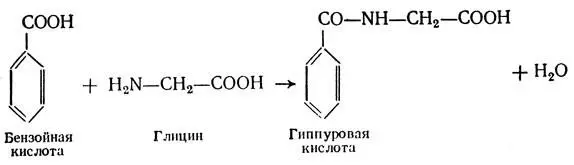
Эта реакция служит в клинике для определения антитоксической функции печени. Чем больше выделяется гиппуровой кислоты, тем выше антитоксическая функция печени.
Судьба аминокислот после всасывания их в кишечнике
Всосавшиеся аминокислоты в кишечнике в основном поступают в кровь воротной вены. Только около 5% попадает в лимфу. По воротной вене они доставляются в печень, где часть их идет на биосинтез различных специфических для организма белков — альбуминов, глобулинов, ферментов, фибриногена крови и др. Другая часть аминокислот током крови разносится по всем органам и тканям, где они используются для биосинтеза белков или подвергаются различным превращениям.
У человека в норме концентрация аминокислот в крови поддерживается на постоянном уровне и составляет в среднем 6-8 мг% из расчета на аминный азот. Основная часть белка содержится в сыворотке крови.
В тканях (мышцы, печень, мозг, почки и т. д.) содержание аминокислот выше, чем в крови, и составляет 40-100 мг% аминного азота.
Использование аминокислот клетками органов и тканей является активным процессом, в котором принимают участие АТФ.
Промежуточный обмен аминокислот
Одним из основных путей превращения аминокислот в организме является биосинтез белка.
Биосинтез белка
Изучению вопросов биосинтеза белка в организме уделяется самое большое внимание, так как это имеет важнейшее научное и клиническое значение. Пока точно не известно, как протекает этот процесс, но успехи биохимии последних двух десятилетий позволяют наметить основные этапы синтеза белка в организме.
Как известно, отличие одного индивидуального белка от другого определяется прежде всего природой и последовательностью чередования аминокислот, входящих в его состав. Передача этих сведений и составляет одну из основных черт биосинтеза белка.
Как было установлено, носителем информации наследственности является молекула ДНК, на которой закодированы генетические особенности организма. Они обусловлены определенной последовательностью азотистых оснований, входящих в структуру ДНК. В состав ДНК входят аденин, гуанин, тимин и цитизин, а в РНК вместо тимина представлен урацил. В ДНК и РНК каждые три последовательно соединенных азотистых основания носят название "трипилет" .
ДНК в основном расположена в ядре клетки, а синтез белка происходит в цитоплазме, на особых клеточных микроструктурах — рибосомах. Передача наследственных особенностей организма, закодированных на ДНК, осуществляется через информациоиную РНК (и-РНК), которая синтезируется по подобию ДНК. В основе передачи информации лежит принцип комплементарности (дополнения), т. е. каждому из 4 оснований в РНК и ДНК соответствует дополнительное, комплементарное основание, что можно записать так:
Читать дальшеИнтервал:
Закладка:









