Михаил Ермолаев - Биологическая химия
- Название:Биологическая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1974
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Ермолаев - Биологическая химия краткое содержание
В учебнике нашли отражение последние научные данные о ферментах, белках, гормонах, обмене веществ и энергии и т. д. Особое внимание обращено на значение и использование данных биохимии в медицине, в связи с чем расширены разделы, посвященные патологии разных видов обменов и их исследованиям в клинике Включены материалы по наследственным заболеваниям, связанным с нарушением синтеза белка и ферментов.
Учебник написан по программе, утвержденной Министерством здраво" хранения СССР, и предназначен для учащихся фельдшерско-лаборантских отделениях медицинских училищ.
Биологическая химия - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
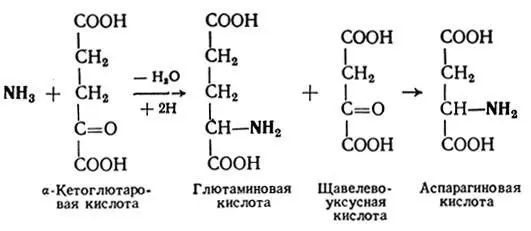
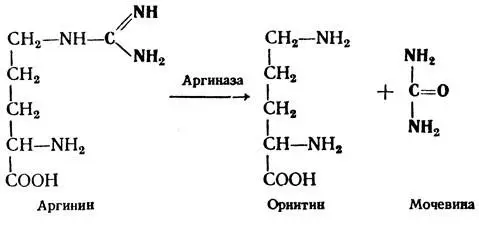
III этап.На этом этапе и происходит синтез мочевины. Цитруллин и аспарагиновая кислота при участии энергии АТФ образуют аргинин-янтарную кислоту, которая расщепляется на фумаровую кислоту и аргинин. Под действием аргиназы аргинин распадается на орнитин и мочевину. Орнитин вновь может включаться в первый этап этого процесса, а образовавшаяся мочевина выводится почками из организма.
Обмен отдельных аминокислот
Аминокислоты, поступающие с пищей или образующиеся при распаде тканевых белков, главным образом идут на синтез белков. Однако многие аминокислоты принимают участие в образовании ряда веществ, которые имеют большое значение для жизнедеятельности организма.
Так, глицин идет на синтез креатина, серина, гемоглобина, пуриновых оснований, сиаловых и парных желчных кислот. Он принимает участие в обезвреживании бензойной, фенил-уксусной кислот и других ядовитых для организма веществ. При дезаминировании аланина образуется пировиноградная кислота, которая участвует в синтезе ацетил-КоА, а также глюкозы и гликогена.
Серии может явиться исходным веществом для образования 3-фосфоглицериновой кислоты, одного из субстратов обмена глюкозы и гликогена, этаноламина (азотистого основания, входящего в состав фосфолипида-кефалина), пировиноградной кислоты, цистеина.
Метионин в организме имеет важное значение как один из основных поставщиков метальных групп, необходимых для синтеза холина, тимина, адреналина и креатина.
Креатин играет важную роль в химических процессах, связанных с мышечным сокращением. Он относится к важнейшим азотистым небелковым соединениям. Креатин синтезируется из аргинина, глицина и метионина.
В мышцах креатин находится не в свободном виде, а в соединении с фосфорной кислотой — в виде фосфокреатина . Он является макроэргическим соединением, обеспечивая энергией процесс мышечного сокращения и синтеза АТФ. При распаде фосфокреатин превращается в креатинин , который выводится с мочой из организма. За сутки в норме выделяется около 2 г креатинина.
Между содержанием в крови фосфокреатина и выделением креатинина с мочой существует прямая зависимость, что позволяет по степени выделения креатинина судить о мышечном развитии тела.
В случае появления в моче креатина — (креатинурия) — предполагается наличие различных заболеваний мышц и авитаминоза Е. Физиологическая креатинурия может быть у беременных женщин и у маленьких детей, но причина ее не выяснена.
Цистеин участвует в синтезе цистина и таурина, необходимого компонента для образования парных желчных кислот.
Значение этих серусодержащих аминокислот заключается еще и в том, что они образуют серную кислоту, которая в активированной форме, в виде фосфоаденозинфосфосульфата (ФАФС) обеспечивает обезвреживание вредных для организма веществ, таких, как крезол, фенол и др. (см. "Гниение белков" ) в кишечнике под влиянием бактерий.
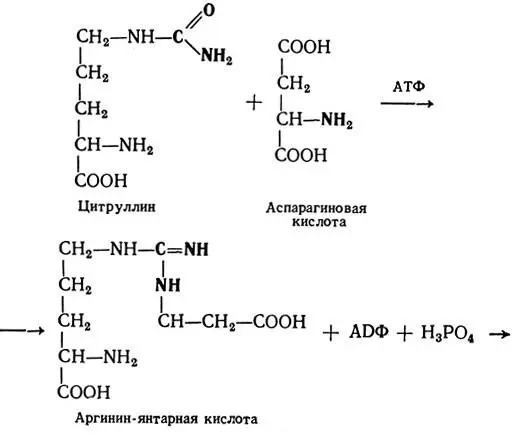
Глютаминовая и аспарагиновая кислоты в организме выполняют многие важные функции. Так, они участвуют в процессе обезвреживания аммиака путем синтеза мочевины и образования амидов — глютамина и аспарагина. В синтезе пуриновых и пиримидиновых оснований принимает участие аспарагиновая кислота.
При декарбоксилировании глютаминовой кислоты образуется γ-аминомасляная кислота— медиатор в центральной нервной системе:
В результате дезаминирования или переаминирования глютаминовой кислоты образуется α-кетоглютаровая кислота — один из основных субстратов цикла Кребса.
Аргинин принимает участие в синтезе мочевины. При распаде лизина образуется глютаминовая кислота. Фенилаланин является предшественником тирозина. Главный путь распада тирозина проходит через стадию гомогентизиновой кислоты до образования конечных продуктов, которыми являются фумаровая и ацетоуксусная кислоты. Однако тирозин в организме подвергается и другим превращениям, в результате которых образуются важные в биологическом отношении вещества. Так, тирозин является исходным продуктом для синтеза гормонов мозгового слоя надпочечников — адреналина и норадреналина. Меланины — темные пигменты — также синтезируются из тирозина.
Тирамин — представитель биогенных аминов — образуется при декарбоксилировании тирозина.
Триптофан. Превращение триптофана также происходит по нескольким путям, одним из которых является эндогенный синтез никотиновой кислоты — витамина PP. Другой путь распада триптофана ведет к образованию биогенного амина — серотонина.
При обмене гистидина может образоваться глютаминовая кислота, а также один из представителей биогенных аминов — гистамин.
Патология белкового обмена
Одной из причин нарушения белкового обмена является его недостаточное потребление. Как установлено, человеку в зависимости от пола, возраста, рода трудовой деятельности в сутки необходимо в среднем 1 -1,5 г белка на 1 кг веса с учетом присутствия в диете всех незаменимых аминокислот в требуемом количестве и определенном соотношении. Институтом питания АМН СССР разработаны нормы суточного потребления незаменимых аминокислот (табл. 7).
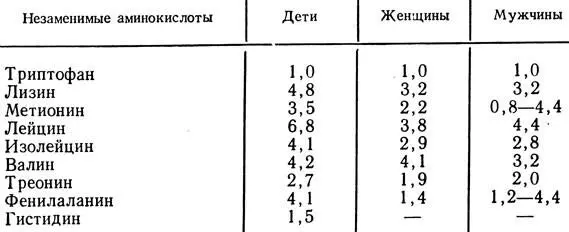
Таблица 7. Суточная потребность незаменимых аминокислот в граммах по отношению к триптофану
Белковое голодание может иметь в своей основе абсолютную недостаточность белка в рационе, когда суточная потребность в белке снижена на 20-30% и более.
Основным средством лечения и предупреждения заболевания является обеспеченность организма необходимым количеством белка в сутки с учетом всех незаменимых аминокислот.
Иногда белковое голодание является вторичным и развивается на основе других заболеваний, например при нарушении процессов переваривания белков в пищеварительном тракте, при кровотечениях, ожоговой болезни, глистных инвазиях, раке, поражениях печени и т. д.
Значительно чаще встречается качественное белковое голодание, связанное с нарушением соотношения аминокислот (имбаланс аминокислот), которое может иметь экзогенное происхождение при недостатке аминокислот в диете или эндогенное, связанное с нарушением обмена отдельных аминокислот внутри организма. Причинами экзогенного имбаланса аминокислот является однообразное белковое питание, с преобладанием белков растительного происхождения и ограниченным потреблением животных белков, и как следствие — недостаточность в рационе незаменимых аминокислот.
Читать дальшеИнтервал:
Закладка:









