Валерий Крылов - Каталитический риформинг бензинов. Теория и практика
- Название:Каталитический риформинг бензинов. Теория и практика
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:2021
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Валерий Крылов - Каталитический риформинг бензинов. Теория и практика краткое содержание
В книге представлен анализ теоретических и практических положений технологии процесса каталитического риформинга бензиновых фракций. Изложен опыт и приведены лучшие практики эксплуатации современных установок риформинга.
Книга предназначена для инженерно-технических работников нефтеперерабатывающих заводов, проектных организаций, преподавателей и студентов вузов.
Каталитический риформинг бензинов. Теория и практика - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
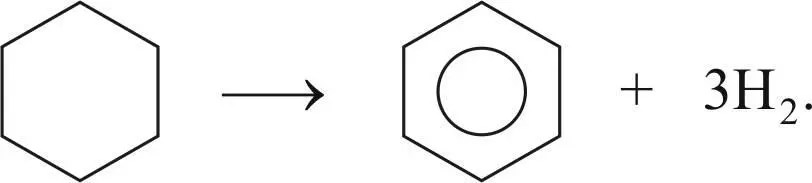
Реакция дегидрирования циклогексана и его гомологов с образованием ароматических углеводородов:
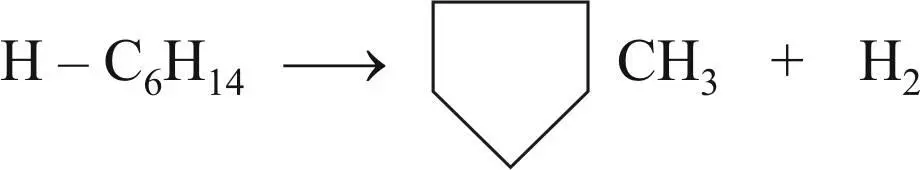
Реакция С 5-циклизации парафиновых углеводородов с образованием метилциклопентана и его гомологов; иногда используется другое название – дегидроциклизация до нафтенов:
.
Реакция изомеризации метилциклопентана и его гомологов с образованием соответствующих нафтенов с 6-членным кольцом:
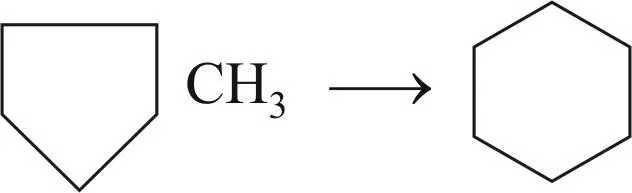
.
Реакция дегидроизомеризации 5-членных нафтенов с образованием ароматических углеводородов; реакция является комбинацией изомеризации и дегидрирования:
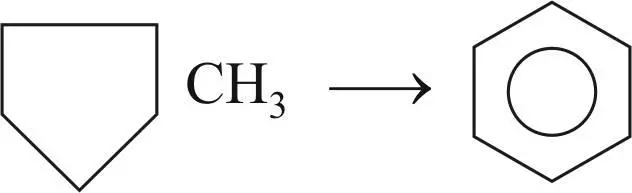
Реакция дегидроциклизации парафиновых углеводородов до ароматических углеводородов; является комбинацией реакций циклизации, изомеризации и дегидрирования:
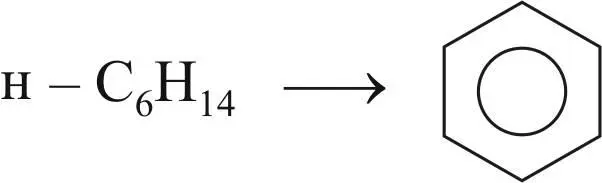
.
Реакция дегидрирования парафиновых углеводородов:
н – С 6Н 14н – С 6Н 12 + Н 2.
Реакция изомеризации парафиновых углеводородов:
н – С 6Н 14изомеры гексана.
Побочными и нежелательными реакциями платформинга являются реакции крекинга и коксообразования.
Реакции крекинга включают гидрокрекинг парафиновых углеводородов на кислотных центрах и гидрогенолиз на металлических центрах катализатора:
реакция гидрогенолиза парафиновых углеводородов
реакция гидрокрекинга
Роль отдельных реакций платформинга иллюстрируется на рис. 6: диаграмма построена для риформинга парафинистой бензиновой фракции ближневосточной нефти [9; 68]. На рис. 6 представлены теоретически возможные выходы и октановые числа при условии отсутствия крекинга на платине. Как следует из рисунка, самым эффективным маршрутом для повышения октанового числа является изомеризация и дегидроциклизация парафиновых углеводородов.
Вклад реакции дегидрирования 6-членных нафтенов обычно ограничен в связи с низким их содержанием в бензиновых фракциях нефти.
Гидрокрекинг является нежелательной реакцией, так как приводит к большой потере выхода С 5+.
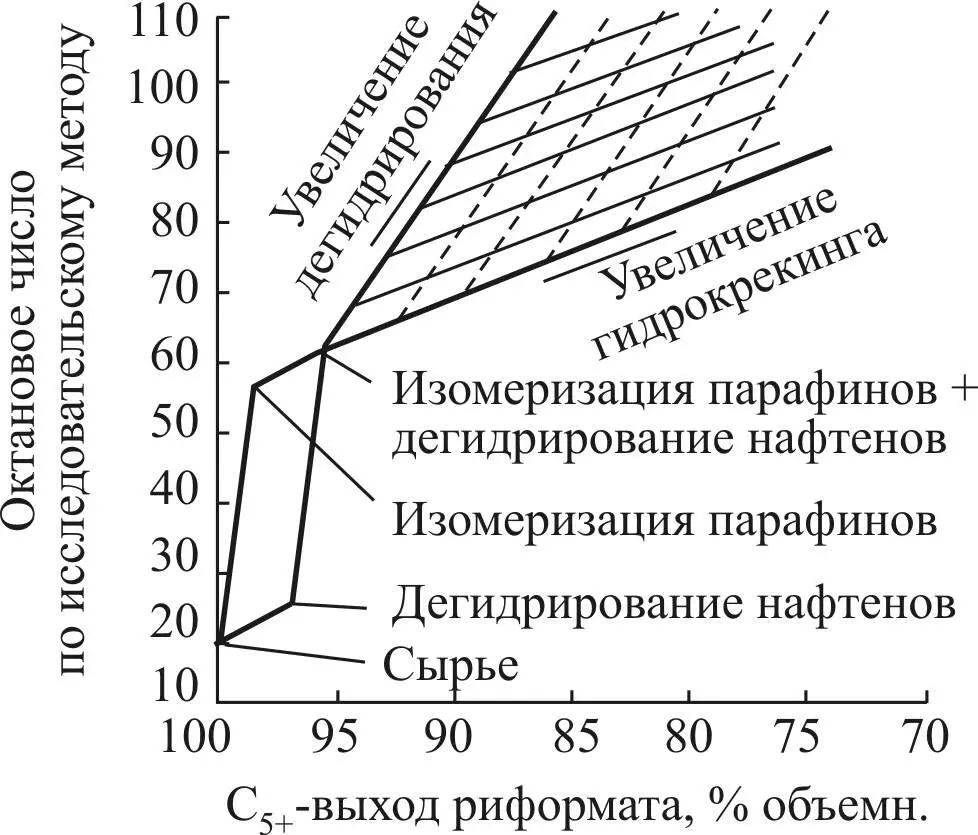
Рис. 6. Вклад отдельных реакций риформинга
в октановое число и выход катализата
Глава 5. Термодинамика
реакций платформинга
Тепловые эффекты, энергии Гиббса и константы равновесия реакций.
Парадоксы равновесия, связанные с протеканием сопряженных реакций.
Влияние температуры и давления на реакции риформинга. Два примера: реакция дегидрирования циклогексана и реакция изомеризации пентана
Основные термодинамические характеристики реакций платформинга включают в себя тепловые эффекты и изменения энтропии, используемые для расчета энергий Гиббса и констант химического равновесия. Ниже, в табл. 2, представлены расчетные значения термодинамических характеристик основных реакций риформинга.
Основные реакции дегидрирования нафтенов и дегидроциклизации парафинов являются сильно эндотермичными. Несколько менее эндотермичны реакции дегидрирования парафинов.
Реакции гидроизомеризации протекают с очень небольшим экзоэффектом.
Умеренно экзотермичны реакции гидрокрекинга и гидрогенолиза парафинов и нафтенов, но вклад этих реакций в общий тепловой эффект невелик в связи с ограничением давления процесса и высокими энергиями активации на платиновом катализаторе.
Превалирование реакции дегидрирования нафтенов и дегидроциклизации парафинов определяет общую высокую эндотермичность процесса и необходимость разделения объема катализатора на несколько слоев с промежуточным печным подогревом реакционной смеси.
Таблица 2
Термодинамические характеристики реакций платформинга
Реакция
кДж/моль
кДж/моль
K р 800
н-гексан ЦГ + Н 2
46,3
11,9
0,17
МЦП ЦГ
–14,5
16,8
0,08
н-гексан н-гексен – 1 + Н 2
130,5
20,2
0,05
ЦГ Б + 3Н 2
220,5
–96,6
1,87Е+6
МЦГ Т + 3Н 2
216,5
–101,2
3,7Е+6
н-гексан 2 – МП
–6,0
–1,5
0,8
н-гексан Б + 4Н 2
266,8
–84,7
3,1Е+5
МЦП Б + 3Н 2
206,0
–79,8
1,19Е+5
н-гексан н-бутан + пропан
–51,5
–53,4
2,9Е+3
н-гексан + Н 2н-гексан + метан
–62,2
–62,3
11,1Е+3
н-гексен – 1 МЦП
–69,7
–25,1
42,6
МЦП-ен ЦГ-ен
+5,6
+10,2
0,218
П р и м е ч а н и е : – энтальпия реакции при температуре 800 К; – изменение энергии Гиббса при температуре 800 К; исходные данные для расчетов взяты в [3].
Эндотермичность риформинга является функцией химического состава сырья и жесткости режима риформирования, задаваемого октановым числом катализата.
Принципиальные ограничения на направление и максимально возможную глубину химических реакций устанавливаются вторым законом термодинамики. В соответствии с этим законом химическая реакция является самопроизвольной (спонтанной) при условии уменьшения энергии Гиббса:
Δ г G < 0.
При химическом равновесии выполняется условие
Δ г G = 0,
где Т – температура реакции; R – газовая постоянная; K p– константа равновесия химической реакции.
Химическое равновесие является динамическим равновесием системы, при котором существует равенство скоростей прямой и обратной реакций, откуда следует равенство
K p = K 1/K 2,
где K 1, K 2– константы скорости для прямой и обратной реакции.
В условиях платформинга состояние равновесия достигается для реакций дегидрирования и изомеризации парафиновых и нафтеновых углеводородов.
Не достигают равновесия реакции дегидроциклизации парафиновых углеводородов и реакции гидрокрекинга и гидрогенолиза углеводородов, которые относятся к медленным и очень медленным превращениям соответственно.
Основные химические реакции платформинга протекают с большим уменьшением энергии Гиббса и поэтому имеют высокие значения констант химического равновесия K p. Исключением являются реакции изомеризации н-алканов и 5-членных нафтенов, а также реакции дегидрирования алканов. Для этих реакций константы равновесия оказываются меньше единицы в связи с небольшим положительным значением энергии Гиббса. Несмотря на невысокие константы равновесия, эти реакции играют важную роль в химической трансформации сырья каталитического риформинга. Ниже это показано на примере реакции изомеризации метилциклопентана в циклогексан.
Читать дальшеИнтервал:
Закладка:









