Нгуэн-Ким Май Тхи - Комично, как все химично! [Почему не стоит бояться фтора в зубной пасте, тефлона на сковороде, и думать о том, что телефон на зарядке взорвется]
- Название:Комично, как все химично! [Почему не стоит бояться фтора в зубной пасте, тефлона на сковороде, и думать о том, что телефон на зарядке взорвется]
- Автор:
- Жанр:
- Издательство:Эксмо
- Год:2021
- Город:Москва
- ISBN:978-5-04-115446-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Нгуэн-Ким Май Тхи - Комично, как все химично! [Почему не стоит бояться фтора в зубной пасте, тефлона на сковороде, и думать о том, что телефон на зарядке взорвется] краткое содержание
Комично, как все химично! [Почему не стоит бояться фтора в зубной пасте, тефлона на сковороде, и думать о том, что телефон на зарядке взорвется] - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Кстати, по той же причине в случае падения лифта следует по возможности лечь плашмя на пол, тогда сила при ударе распределится по большей поверхности. Но когда падаешь, лечь очень трудно, потому что находишься как бы в состоянии невесомости. Для подстраховки следовало бы с самого начала ехать в лифте лежа, что, однако, чревато всякими казусами с попутчиками по лифту. Но это так, к слову, лифты сейчас надежны, так что не упадут.
Вернемся к дисплеям. На всякий случай лучше подстраховаться и купить защитную пленку, пусть даже ваш прекрасный смартфон потеряет свою изящность. У меня вот дисплей еще ни разу не разбивался. Но сейчас, пока еду в автобусе к Кристине, обнаруживаю, что скоро сядет батарейка, и мобильник выключаю.
Время работы батареи – больная тема, верно? А помните, на сколько хватало заряда в мобильниках лет 15 назад? Их можно было заряжать каждые три-шесть дней, в зависимости от того, как долго на них играли в «Змейку». Сегодня я довольна, если мобильник хотя бы день прожил без подзарядки. Но, разобравшись, как такая батарейка устроена с точки зрения химии, вы поймете, как с ней лучше обращаться, чтобы она дольше держала заряд. И здесь мы подходим к другой стороне вопроса «Что мне это дает?». Я периодически слышу высказывания, что нечего в школе корпеть над естественными науками – в жизни они, мол, не понадобятся. Надеюсь, сейчас вы посмотрите на этот вопрос иначе.
Итак. Существуют разные типы батареек и аккумуляторов. Для ежедневного использования в наше время лучше всего подходит литий-ионная батарейка(или аккумулятор). Apple их тоже использует, и на сайте написано: «По сравнению с традиционными батареями литий-ионные быстрее заряжаются, дольше держат заряд, и удельная мощность у них выше – они более долговечны при том, что весят меньше ». Вероятно, есть веские причины, почему мобильные телефоны, планшеты, лэптопы (и электромобили «Тесла», кстати, тоже) работают на литий-ионных батареях.
Краткое лексическое отступление: в этой главе я буду говорить только о перезаряжаемых батареях, как бы я их ни называла – аккумулятор или батарея. Вообще-то различие есть: батареи (их еще называют первичными батарейками) после использования перезарядке не подлежат. Аккумуляторы, или вторичные батареи, можно снова заряжать. Но поскольку аккумуляторы – это многократно подзаряжаемые батареи, по сути, они все же батарейки, так и будем их называть.
Батарейка обеспечивает прибор энергией, то есть потоком электронов, служит их портативным донором и устроена по следующему принципу.
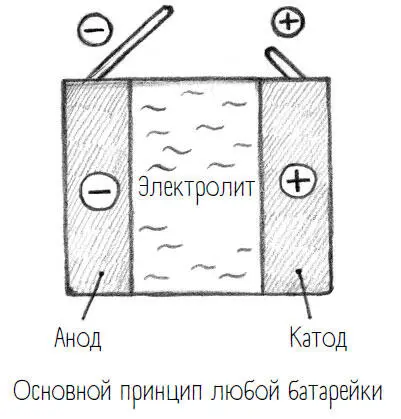
Важнейшие компоненты батарейки – электроды: один на положительном полюсе, другой на отрицательном. Положительно заряженный электрод называется катодом, отрицательно заряженный – анодом. Полюса соединены между собой проводящим кабелем, который проложен через мобильник и снабжает его компоненты энергией, то есть электроны идут от анода к катоду через мобильник. Внутри батарейки электроды тоже соединены – через так называемый электролит(это собирательное название жидкостей или твердых веществ, способных проводить электрический ток). Однако электролиты проводят не электроны, а ионы – как положительные, так и отрицательные. Кстати, мы сами большей частью состоим из электролита, то есть из воды с разнозаряженными ионами.
Грубо говоря, батарейка – это катод, анод и электролит. А какие химические вещества для каждого из этих компонентов используются, зависит от типа батареи.
В литий-ионной батарее катод обычно состоит из соединения лития, кислорода и еще одного металла, например кобальта. Все вместе получается оксид лития-кобальта. Атомы кобальта и кислорода образуют слои, между которыми заключены ионы лития.
Анод чаще всего состоит из графита, то есть по сути из углерода. Графит также уложен слоями.
Подключая мобильник к зарядному кабелю, я подаю на батарейку обратное напряжение. И тут происходит нечто, что приводит к путанице в терминах. Вот мы только что узнали два новых понятия – анод и катод, – и нам уже придется поменять их местами. Когда батарейка заряжается, положительные электроды из оксида лития-кобальта мы называем анодами, а отрицательные электроды из графита – катодами. То есть точно наоборот, чем при разрядке батарейки. Зачем химикам так все усложнять? Это имеет кое– какое отношение к происходящим в электродах химическим реакциям. К этому мы еще вернемся, но пока, пожалуй, следует разобраться с положительным и отрицательным полюсами.
Когда я заряжаю мобильник, отрицательный полюс заряжается электронами, перемещающимися в графит. В результате загрузки возникает переизбыток отрицательного заряда. Это в принципе усложняет зарядку, потому что одинаковые заряды отталкиваются друг от друга, то есть отрицательный от отрицательного, а положительный от положительного. Поэтому не получится так запросто полностью накачать электроды отрицательно заряженными электронами. Но противоположные заряды взаимно компенсируются, потому здесь в игру вступают положительно заряженные ионы лития, дающие название литий-ионной батарейке. Они ускользают из положительного полюса (электрод из оксида лития-кобальта), проходят через электролиты до графитового электрода и там, на отрицательном полюсе, получают отрицательные электроны. Это называется компенсацией зарядов– она обеспечивает полную зарядку электронами.
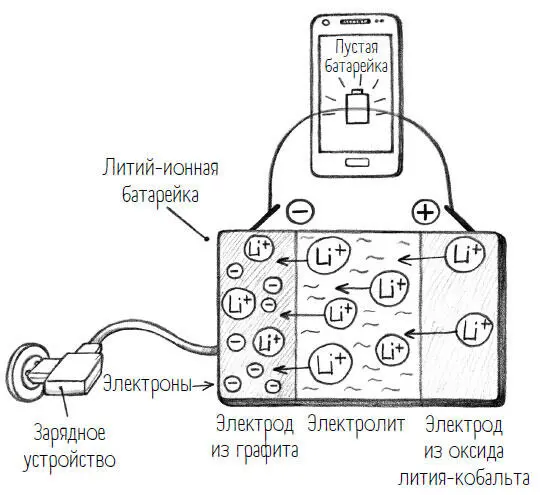
Теперь электроны не околачиваются просто так где-то «на районе», а приняты самым сердечным образом. Для химиков среди моих читателей приведу уравнение этой реакции: Сn + xLi+ + xe– = LixCn. Не-химикам не стоит беспокоиться; вам здесь вообще-то интересна только одна часть этого уравнения, а именно «+ xe-». «Х» здесь означает просто любое количество, а «е-» – электрон, а все вместе говорит о том, что в этой химической реакции были приняты электроны. Это называют восстановлением. Восстановление в химии – это реакция, при которой атомы или ионы присоединяют электроны (а степень окисления понижается).
Поскольку теперь я полностью «заправила бак» (отрицательный полюс своего мобильника) электронами, а положительный полюс электронов не содержит, тем самым между двумя полюсами создается электрическое напряжение. Давайте представим электрическое напряжение как перепад высот для потока электронов по аналогии с плотиной на реке. Загрузить отрицательный полюс электронами – все равно что поднять воду снизу наверх. Если теперь открыть шлюз, вода водопадом грохнется вниз. Именно это и происходит, когда я вынимаю зарядный кабель. При пользовании мобильником химическая реакция поворачивается вспять: принятые электроны снова отдаются. Теперь в качестве электрического тока они носятся по всему мобильнику. Реакция, противоположная восстановлению, называется окислением. Окисление – это химическая реакция, при которой электроны отдаются.
Читать дальшеИнтервал:
Закладка:
![Обложка книги Нгуэн-Ким Май Тхи - Комично, как все химично! [Почему не стоит бояться фтора в зубной пасте, тефлона на сковороде, и думать о том, что телефон на зарядке взорвется]](/books/1060968/nguen.webp)









