Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Название:Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1980
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи краткое содержание
Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Работа Хунда [54, II] была посвящена исследованию характерных свойств полосатых спектров двухатомных молекул (как гомо-, так и гетеронуклеарных). В дальнейшем наряду с электронной он рассматривал также колебательную и вращательную структуры этих спектров [54, III-V]. Мы остановимся только на первых двух работах, наиболее повлиявших на процесс создания молекулярно-орбитальной теории молекул.
Согласно Хунду, электронную систему двухатомной молекулы можно представить как построенную путем последовательного добавления в поле двух атомных ядер по два электрона. При этом возникает вопрос: какое квантовое состояние займет каждый из добавляемых электронов, т. е. какова последовательность одноэлектронных квантовых состояний? Очевидно, что она зависит как от зарядов атомных ядер, так и от расстояния между ними. Хунд рассматривает два случая — малые и большие межъядерные расстояния R.
Если R мало по сравнению с эффективными размерами электронных оболочек атомов, то молекулярные термы должны быть подобны термам атомным [23] Связь молекулярных термов с атомными была рассмотрена в 1928 г. также Вигнером, но в более общем виде с помощью теории групп.
. При этом атомному Р-терму будут соответствовать два близких по энергии 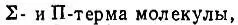 атомному D-терму — три молекулярных:
атомному D-терму — три молекулярных: 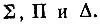
Одноэлектронные состояния образуют при малых R ту же последовательность, что и в атоме: 1s, 2s, 2p, 3s, 3р, 4s, 3d,..., если система электронейтральна или ее заряд мал; и 1s, 2s, 2p, 3s, 3р, 3d, 4s,..., если суммарный заряд ядер существенно больше числа электронов.
Простейшим случаем, рассмотренным Хундом, является атом, содержащий замкнутые электронные оболочки и один р-электрон в незамкнутой оболочке. Такой атом находится в состоянии 2Р. Мысленное расщепление ядра приводит к понижению сферической симметрии до аксиальной и, следовательно, к расщеплению 2Р-терма на 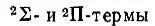 при допущении, что 2∏-терм лежит выше терма 2∑.
при допущении, что 2∏-терм лежит выше терма 2∑.
При наличии сверхзамкнутой оболочки лишь одного d-электрона 2D-терм объединенного атома порождает молекулярные 2∏-, 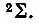 - и 2Δ-термы, приведенные здесь в порядке возрастания их энергии. При наличии пяти эквивалентных р-электронов соответствующий 2Р-терм порождает
- и 2Δ-термы, приведенные здесь в порядке возрастания их энергии. При наличии пяти эквивалентных р-электронов соответствующий 2Р-терм порождает 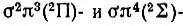 -состояния, причем последнее имеет большую энергию. При добавлении еще одного электрона из двух указанных выше термов, 2∏ и 2∑, возникает терм
-состояния, причем последнее имеет большую энергию. При добавлении еще одного электрона из двух указанных выше термов, 2∏ и 2∑, возникает терм 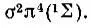
Приведенные выше рассуждения Хунда относились к случаю, когда расстояние между ядрами являлось достаточно малым, чтобы расщепление атомных термов было существенно меньше, чем расстояние между ними на шкале энергии. Если теперь несколько увеличить межъядерное расстояние и (одновременно) взаимодействие электронов считать несколько меньшим, то энергетическая последовательность электронных уровней будет определяться в первую очередь квантовыми числами n и l, во вторую очередь — квантовым числом |m| и только в третью очередь — квантовыми числами полного спина и абсолютной величиной проекции полного орбитального момента импульса на ось молекулы. Последовательность одноэлектронных состояний характеризуется тогда рядом
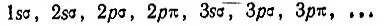
Обратимся теперь к рассмотренному Хундом случаю разделенных атомов. При достаточном разведении атомных ядер термы двухатомной молекулы должны перейти в атомные термы. Если заряды ядер одинаковы (гомонуклеарная молекула), то атомные орбитали могут порождать молекулярные орбитали согласно схеме:
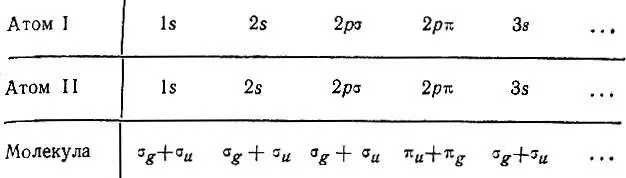
Атомные 1s-уровни при сближении ядер расщепляются на два молекулярных одноэлектронных σ-уровня, один из которых соответствует молекулярной орбитали, симметричной относительной плоскости, равноотстоящей от ядер и перпендикулярной к оси молекулы. Этот уровень, согласно Хунду (а также Гайтлеру и Лондону), лежит ниже, чем второй σ u-уровень, соответствующий антисимметричной орбитали.
При мысленном сведении ядер до их слияния симметричная молекулярная оуорбиталь переходит в 1s-орбиталь объединенного атома, антисимметричная — в 2р-орбиталь. Поэтому эти состояния Хунд обозначает символами 1sσ и 2рσ т. е. он рассматривает молекулу с точки зрения объединенного атома. Такой взгляд был впоследствии подвергнут критике Леннард-Джонсом и Герцбергом.
Для четырех первых электронов двухатомной молекулы при большом межъядерном расстоянии реализуется конфигурация (1sσ) 2(2pσ) 2. Если затем добавить к ним пятый, то ему будет соответствовать 2s-орбиталь разъединенных атомов. Две таких орбитали, принадлежащие разным атомам, при сближении ядер преобразуются в симметричную и антисимметричную молекулярные σ-орбитали, причем энергия первой ниже, чем энергия второй, что следует из корреляции этих МО с орбиталями объединенного атома: симметричной МО соответствует 2sσ-AO, антисимметричной — 3pσ.
Таким образом, следует ожидать следующую последовательность одноэлектронных состояний двухатомной молекулы в порядке возрастания соответствующих им энергетических уровней: 1sσ, 2pσ, 2sσ, 3pσ, ...
Для первых восьми электронов при больших межъядерных расстояниях реализуется конфигурация (1sσ) 2(2pσ) 2(2sσ) 2(3pσ) 2. Девятый электрон соответствует 2р-орбитали разъединенного атома. Шесть таких орбиталей (по три от каждого атома) преобразуются при сближении ядер в следующие МО: симметричную σ g-МО, антисимметричную σ u-МО и две двукратно вырожденные симметричные π u-МО. Устанавливая соответствие между МО и АО объединенного атома, Хунд определил, что первая из названных выше МО является sσ (или dσ)-орбиталью, вторая- рσ-орбиталью, третья — pσ — и последняя dπ-орбиталями. При этом состояние 3sσ по энергии должно лежать ниже, чем 4рσ, а 2рπ ниже, чем 3dπ. По мнению Хунда, наиболее вероятной является следующая последовательность одноэлектронных состояний в порядке возрастания их энергии:
Читать дальшеИнтервал:
Закладка:









