Михаил Левицкий - Карнавал молекул. Химия необычная и забавная
- Название:Карнавал молекул. Химия необычная и забавная
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2019
- Город:Москва
- ISBN:978-5-0013-9101-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Левицкий - Карнавал молекул. Химия необычная и забавная краткое содержание
В книге рассказано о некоторых драматичных, а, порой, забавных поворотах судьбы как самих открытий, так и их авторов. Кроме того, читатель потренируется в решении занятных задач, что особенно приятно, когда рядом помещена подсказка, а потом и сам ответ.
В отличие от учебника в книге нет последовательного изложения основ химии, поэтому ее можно читать, начиная с любой главы.
Карнавал молекул. Химия необычная и забавная - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Авторы пропускали азот через раствор, содержащий каталитическую систему – комплексное соединение титана (C 5H 5) 2TiCl 2с восстановителем (магнийорганическим соединением C 2H 5MgBr), в результате из азота получался аммиак NH 3.
Полученный результат был абсолютно новым и исключительно важным, поэтому авторы приложили специальные усилия, чтобы доказать его истинность. Необходимо было снять подозрение, что источником образующегося аммиака могли оказаться различные азотсодержащие примеси в используемых реактивах. Были проведены специальные опыты, в которых использовали исходный молекулярный азот N 2, содержащий изотоп 15N. Такая изотопная метка, которую специальными методами можно обнаружить в соединениях, позволяет «проследить» за перемещением атомов азота из одного соединения в другое. Эксперименты показали, что в полученном аммиаке практически то же количество изотопа 15N, что и у введенного в реакцию молекулярного азота.
Позже удалось более детально описать этот процесс. В реакционной смеси образуется промежуточное соединение – комплекс титана, в котором атом металла окружен двумя циклическими молекулами (С 5Н 5) и алифатической группой – СН(СН 3) 2. Молекула азота встраивается между двумя такими молекулами, полученный «агрегат» даже удалось зафиксировать при низкой температуре. Далее, в зависимости от условий, полученное соединение в результате гидролиза образует гидразин H 2N – NH 2либо аммиак NH 3.
Напомним, что катализатор должен работать в небольших количествах, обеспечивая превращение большого количества реагентов. Все рассмотренные выше системы позволяли получать аммиак при соотношении одна молекула NH 3на один атом T1. Практически это не катализ, а обычная реакция, поскольку соединение титана участвует как рядовой реагент. Авторам работы удалось найти каталитическую систему ТiСl 4 – АlВг 3 – Аl, которая при давлении 10 МПа и 130 °С дает почти 300 молей аммиака на 1 моль ТiСI 4. Такое соотношение можно уже рассматривать как истинный катализ.
Изучая возможности найденных каталитических систем, авторы установили, что если в состав восстанавливающего компонента ввести фенильную группу, то в результате можно получить из молекулярного азота анилин. Такой результат производит впечатление: фактически это получение промышленно важной органической молекулы непосредственно из азота N 2. Каталитическая система представляет собой композицию из комплекса титана (C 5H 5) 2ТiСl 2и фениллития РhLi. На первой стадии возникает фенилпроизводное титана (фенильная группа переходит к титану от лития), затем молекула азота внедряется по связи Ti – Ph. Образовавшееся соединение при действии восстановителя и кислоты (Н +) образует анилин и аммиак.
Открытие фиксации молекулярного азота в мягких условиях стало заметным этапом в науке о катализе и привело к появлению целого потока исследований. Например, были найдены каталитические системы, которые работают даже в водной среде, таким образом, исследователи решили проблему не менее эффективно, чем это делают азотфиксирующие бактерии. Впрочем, химия постоянно демонстрирует свое могущество, предлагая замечательные новые композиции и материалы, не существующие в природе.
Интересно, что открытие фиксации азота вышло за рамки химической науки и, по-видимому, произвело впечатление на многих, в том числе и на деятелей искусства. В 1981 г. на экраны вышел фильм Леонида Марягина «Незваный друг». В фильме есть эпизод: молодой ученый (исполнитель – Олег Даль) кладет на стол научному руководителю (его играет Олег Табаков) свою диссертацию, тема диссертации – фиксация азота (рис. 3.20).

С некоторой долей уверенности можно полагать, что прообразами этих героев послужили первооткрыватели процесса М.Е. Вольпин и В.Б. Шур.
Диалог с атомом
Спорить умеют многие,
мало кто умеет просто беседовать.
АМОС БРОНСОН ОЛКОТТСмысл любого исследования – задавать вопросы природе, и если они поставлены удачно, то природа, скорее всего, сумеет по достоинству оценить проявленный к ней интерес. Такой диалог всегда имеет продолжение: завершенное исследование заканчивается не только готовыми результатами, но и появлением новых вопросов, что делает сам процесс исследования еще более увлекательным. Прежде чем начать беседу с атомом, проведем небольшую разминку.
Зримое решение
Кирпич весит полкирпича плюс 1 кг. Сколько весит кирпич (естественно, в килограммах)? Большинство отвечает сразу, не задумываясь: 1,5 кг, проверьте это на своих знакомых. Ответ неправильный, а решить задачу без ошибки проще всего зрительно. Поставьте мысленно на одну чашку весов кирпич, а на другую – полкирпича и гирю в 1 кг (как по условию задачи). Теперь так же мысленно уберите гирю. Что надо поставить вместо нее, чтобы весы остались в равновесии?
Разумеется, еще полкирпича (рис. 3.21).
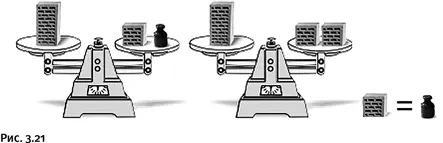
Такая замена нас убедит, что полкирпича имеет ту же массу, что и килограммовая гиря. Если полкирпича весит 1 кг, то целый кирпич – 2 кг.
Не самые удобные запасы
Основой промышленного синтеза громадного числа органического соединений, а также базой для производства полимеров служит главный сырьевой источник – нефть, не менее значим также природный газ, использование которого для процессов органического синтеза предпочтительнее, но пока менее развито. Третий широко известный источник углерода – каменный уголь.
К сожалению, следует признать, что природа заготовила для нас запасы углерода не в самом удобном виде. Известно, что чем инертнее вещество, тем оно лучше сохраняется, и именно потому существуют большие запасы нефти в земной коре. Нефть почти на 80 % состоит из насыщенных углеводородов – парафинов (в их названии содержится указание на химическую инертность: parum affinis – лишенный сродства) и нафтенов (циклических углеводородов).
Возможно, некоторые полагают, что нефть и газ не такие уж инертные вещества, они же очень легко сгорают. Этот процесс полезен с точки зрения энергетика, но химик считает, что сжигание – это разрушение, а не созидание полезных веществ.
Если мы хотим использовать нефть и газ как сырье для синтеза, то должны научиться превращать исходные углеводороды в соединения с реакционноспособными группами. Для этого необходимо уметь разрывать связи С – Н и С – С (рис. 3.22).
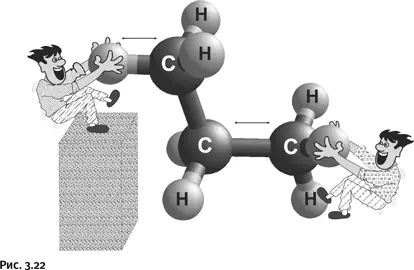
На сегодня существуют достаточно хорошо разработанные методы таких превращений, однако большинство из них, такие, например, как крекинг (разрыв связи С – С) или галогенирование (разрыв связи С – Н), очень энергоемки и неселективны (неизбирательны), они дают широкий набор различных продуктов.
Читать дальшеИнтервал:
Закладка:









