Михаил Левицкий - Карнавал молекул. Химия необычная и забавная
- Название:Карнавал молекул. Химия необычная и забавная
- Автор:
- Жанр:
- Издательство:Литагент Альпина
- Год:2019
- Город:Москва
- ISBN:978-5-0013-9101-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Михаил Левицкий - Карнавал молекул. Химия необычная и забавная краткое содержание
В книге рассказано о некоторых драматичных, а, порой, забавных поворотах судьбы как самих открытий, так и их авторов. Кроме того, читатель потренируется в решении занятных задач, что особенно приятно, когда рядом помещена подсказка, а потом и сам ответ.
В отличие от учебника в книге нет последовательного изложения основ химии, поэтому ее можно читать, начиная с любой главы.
Карнавал молекул. Химия необычная и забавная - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Интересно, что здесь хелатная группа работает по прямому назначению: не участвует в реакциях с цирконием, а только прикрывает его, заполняя координационную сферу металла (координационная связь обозначена пунктирной стрелкой на рис. 3.30).
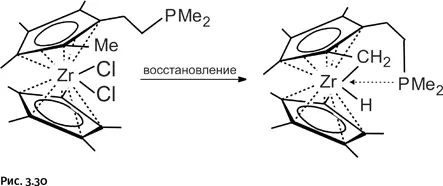
Все рассмотренные превращения показывают, что комплексы Zr 2+неустойчивы и переходят в соединения Zr 4+, реагируя с теми группами, которые ему услужливо протягивают «клешни», или привлекая метильные группы СН 3у цикла.
Тем не менее уберечь от взаимодействия Zr 2+все же возможно, когда атом циркония ничего не присоединяет к себе, а лишь подтягивает хелатные группы. Это удалось реализовать, когда для восстановления было взято соединение не с одной, а с двумя «клешнями», содержащими РМе 2. Степень окисления циркония в исходном и конечном соединении указана римскими цифрами, стоящими у символа Zr (рис. 3.31).
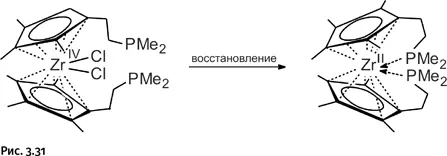
Теперь поведение восстановленного циркония в общих чертах понятно. Действительно, как следует из всего рассмотренного выше, единственная метильная группа в хелате, которую цирконий «не трогает», – та, что связана с фосфором.
Итак, цирконий вполне успешно начинает вторгаться в область, где уверенно лидировали благородные металлы, и при этом он демонстрирует большие возможности: восстановленные комплексы циркония могут разрывать связи O – C, S – C, C – H. В этом весьма представительном наборе не хватает, пожалуй, только связи С – С, но можно полагать, что будут найдены способы решить и эту проблему. Обратите внимание, как своеобразно поставил эксперимент автор работы. Он «протягивал» атому циркония различные группы и наблюдал, что он с ними делает, причем все происходило в пределах одной молекулы. Это напоминает кормление аквариумной рыбки, когда владелец хочет выяснить, какую пищу она предпочитает.
Далее следует научиться проводить превращения не с группами, входящими в состав комплекса (не внутримолекулярно), а с реагентами, приближающимися к комплексу извне (рис. 3.32).
Как это часто бывает, полученные результаты сами формулируют новые задачи, что вносит некоторый азарт в исследование и делает его интереснее.
Каталитические этюды
Просто не хочется верить,
что целое не знакомо
со своими частностями.
Е. ЛЕЦСовременное учение о катализе представляет собой гигантское живописное полотно, на котором с большого расстояния можно различить два частично пересекающихся сюжета. Первый рассматривает процессы, с помощью которых химики стремятся научиться делать то, что давно умела делать природа. Речь идет в первую очередь о синтезе разнообразных органических веществ, получаемых живыми организмами буквально из земли, воды и воздуха. Не пытаясь в точности воспроизвести природу, наши великолепные предшественники достигли многого, особенно при получении лекарственных веществ и различных биологически активных препаратов.
Теперь мы переходим ко второму сюжету упомянутой картины. Он охватывает те процессы, которые природа делать не умеет, скорее всего, за ненадобностью: например, ни в органическом, ни в минеральном мире мы не встречаем процессов хлорирования, нитрования, полимеризации и т. п. Однако реакции такого типа крайне необходимы для получения многих продуктов, без которых современная цивилизация обойтись не может. О нескольких небольших зарисовках, дополняющих эту часть большой картины, далее пойдет речь.
Как преодолеть узкое место?
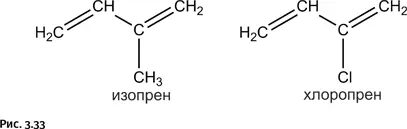
Модифицированием свойств натурального каучука химики занялись довольно давно. Один из самых удачных результатов был получен, когда в молекуле изопрена H 2C=CH – C(CH 3)=CH 2(мономер, из которого образуется натуральный каучук) метильную группу заменили хлором H 2C=CH – C(Cl)=CH 2, получив хлоропрен (рис. 3.33).
Полимерный хлоропрен, называемый обычно хлоропреновым каучуком, исключительно устойчив к действию бензина и масел. Получают хлоропрен по следующей цепочке процессов: вначале галогенируют бутадиен (углеводород с двумя двойными связями), при этом одна из двойных связей раскрывается, присоединяя два атома хлора, в результате возникают два продукта: а) симметричный, у которого атомы хлора расположены на концевых атомах углерода, и б) несимметричный, когда атомы хлора находятся у соседних атомов углерода (рис. 3.34).
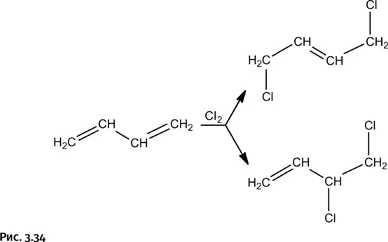
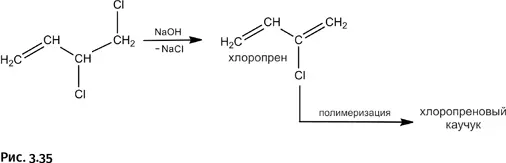
Симметричный продукт для получения хлоропренового каучука не годится, нужен только несимметричный. От него отщепляют HCl действием щелочи, при этом возникает новая двойная связь – образуется хлоропрен, который затем полимеризуют с получением хлоропренового каучука (рис. 3.35).
На всех стадиях, кроме самой первой, выход составляет 95–98 %, узкое место – первая стадия (результат галогенирования), поскольку несимметричный продукт, необходимый для дальнейших превращений, образуется в количестве почти вдвое меньшем, чем симметричный. В связи с этим в технологическую цепочку включают еще одну стадию, которая позволяет симметричное соединение перевести в несимметричное. Фактически это изомеризация, но провести ее можно только в присутствии катализатора, потому процесс и называют каталитической изомеризацией. Процесс обратимый, что обозначено сдвоенными стрелками. Таким образом, 100 %-ное превращение осуществить невозможно, система дойдет до равновесия, и образуется смесь обоих соединений, что уже неплохо, так как часть нужного продукта мы все же получим (рис. 3.36).
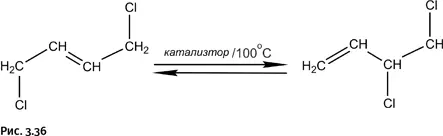
Катализатор не может сдвинуть равновесие: если в его присутствии увеличивается скорость прямой реакции, то соответственно возрастает скорость и обратного процесса. Таким образом, задача катализатора – ускорить обе реакции одновременно, т. е. сократить время, необходимое для достижения равновесия. Далее задача решается чисто технически: после того как равновесие достигнуто, из реакционной массы отгоняют несимметричный продукт, а в оставшейся реакционной смеси вновь восстанавливается его равновесная концентрация. Чем быстрее с помощью катализатора достигается равновесие, тем лучше работает катализатор и, следовательно, тем эффективнее процесс.
Читать дальшеИнтервал:
Закладка:









