Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
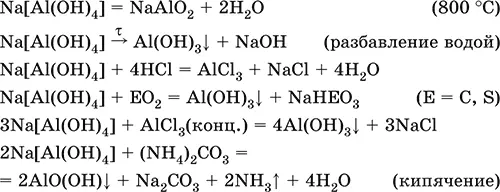
Получение : взаимодействие Al(ОН) 3и солей алюминия с NaOH в концентрированном растворе:
Al(OH) 3+ NaOH(конц.) = Na[Al(OH) 4]
AlCl 3+ 4NaOH(конц.) = Na[Al(OH) 4]+ 3NaCl
Образуется из оксида алюминия (см.) как промежуточный продукт при промышленном «вскрытии» бокситов.
1. Среди металлов главной подгруппы II группы наиболее сильнымвосстановителем является
1) барий
2) кальций
3) стронций
4) магний
2. При сжигании магния на воздухе образуются
1) Mg(OH) 2
2) MgO
3) Mg(NO 3) 2
4) Mg 3N 2
3. Алюминий будет выделять водород из реактива
1) HNO 3(разб.)
2) NaHSO 4(разб.)
3) H 2SO 4(конц.)
4) NaOH (конц.)
4. Реакция замещения протекает в растворе между алюминием и
1) Na 2SO 4
2) BeSO 4
3) NiSO 4
4) MgSO 4
5. Из раствора гидрокарбоната бария выпадает осадок при добавлении реактивов
1) ВаО
2) СO 2
3) Ва(ОН) 2
4) H 2SO 4
6. Калий можно получить электролизом на угольных электродах из
1) раствора КCl
2) раствора KNO 3
3) расплава КCl
4) расплава смеси КCl и MgCl 2
7—8. Если внести каплю раствора
7. поваренной соли
8. хлорида калия
в бесцветное пламя газовой горелки, оно станет
1) красным
2) желтым
3) зеленым
4) фиолетовым
9. Устранение временной жёсткости воды проводится по реакции
1) Са(НСO 3) 2+ Na 3PO 4 →…
2) Са(НСO 3) 2+ Са(ОН) 2→…
3) CaSO 4+ Na 2CO 3→…
4) СаCl 2+ NaHCO 3→…
6. Переходные металлы 4-го периода. Свойства, способы получения. Общие свойства металлов
6.1. Хром
Хром – элемент 4-го периода и VIБ-группы Периодической системы, порядковый номер 24. Электронная формула атома [ 18Ar]3d 54s 1, характерные степени окисления +VI, + III и 0.
Шкала степеней окисления хрома:
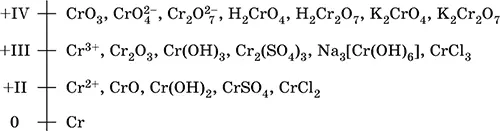
По электроотрицательности (1,56) хром занимает промежуточное положение между типичными металлами (Na, К, Са) и типичными неметаллами (F, О, N. CI, S). Соединения Cr IIIпроявляют амфотерные свойства, металлические (основные) свойства преобладают у Cr II, неметаллические (кислотные) – у Cr VI; в соединениях хром чаще находится в составе катионов и реже – в составе анионов. Хром образует многочисленные соли и бинарные соединения.
В природе – девятнадцатыйпо химической распространенности элемент (десятый среди металлов), находится только в виде соединений (минералы, полиметаллические руды). Растворимые соли хрома ядовиты.
Хром Cr.Серый (с голубоватым оттенком) металл, очень твердый, ковкий (технический продукт – хрупкий). Блестящий, хотя покрыт очень тонкой оксидной пленкой, сохраняет блеск даже во влажном воздухе. Не реагирует с водой, щелочами и гидратом аммиака, пассивируется в концентрированной и разбавленной азотной кислоте и в «царской водке».
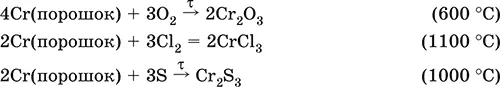
В ряду напряжений стоит левее водорода, из разбавленных кислот HCl и H 2SO 4вытесняет водород:
Cr + 2H += Cr 2++ Н 2↓
Далее катион Cr 2+можно перевести кислотами-окислителями в катион Cr 3+:

Хром реагирует в расплаве с сильными окислителями:
2Cr + КClO 3= Cr 2O 3+ КCl (500–700 °C)
2Cr + 3KNO 3= Cr 2O 3+ 3KNO 2(400–550 °C)
Получение хрома в промышленности – алюминотермия:
Cr 2O 3+ 2Al = 2Cr + Al 2O 3(800 °C)
и электролиз раствора:
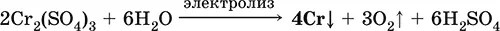
Промышленно важен сплав хрома с железом — феррохром (6O—85 % хрома), его производят восстановлением оксидов, например минерала хромит:
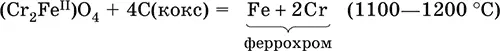
Применяется хром для создания защитных покрытий на других металлах ( хромирование ), как компонент механически прочных и коррозионно-стойких сталей.
Гидроксид хрома (III) Cr(ОН) 3.Амфотерный гидроксид. Серо-зеленый, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид CrО(ОН). Не растворяется в воде. Из раствора осаждается в виде серо-голубого и голубовато-зеленого гидрата. Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака. Применяется для синтеза соединений хрома (III).
Уравнения важнейших реакций:
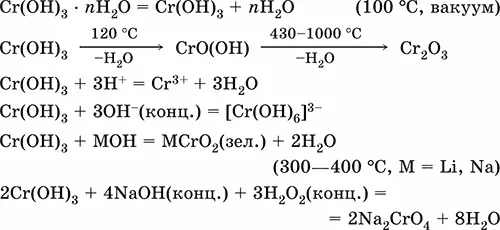
Получение: осаждение гидратом аммиака из растора солей хрома(III):
Cr 3++ 3(NH 3Н 2O) = Cr(OH) 3↓ + 3NH 4 +
Хромат калия К 2CrO 4.Оксосоль. Желтый, негигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде ( желтаяокраска раствора отвечает иону CrO 4 2-), незначительно гидролизуется по аниону. В кислотной среде переходит в К 2Cr 2O 7. Окислитель (более слабый, чем К 2Cr 2O 7). Вступает в реакции ионного обмена.
Качественная реакция на ион CrO 4 2-– выпадение желтого осадка хромата бария, разлагающегося в сильнокислотной среде. Применяется как протрава при крашении тканей, дубитель кож, селективный окислитель, реактив в аналитической химии.
Уравнения важнейших реакций:
2К 2CrO 4+ H 2SO 4(30 %) = К 2Cr 2O 7+ K 2SO 4+ Н 2O
2К 2CrO 4(т)+ 16HCl (конц., гор.) = 2CrCl 3+ ЗCl 3↑ + 8H 2O + 4КCl
2К 2CrO 4+ 2H 2O + 3H 2S = 2Cr(OH) 3↓ + 3S↓ + 4KOH
2К 2CrO 4+ 8H 2O + 3K 2S = 2K 3[Cr(OH) 6] + 3S↓ + 4KOH
2К 2CrO 4+ 2AgNO 3= 2KNO 3+ Ag 2CrO 4(красн.)↓
Качественная реакция:
К 2CrO 4+ ВаCl 2= 2КCl + ВаCrO 4↓
2BaCrO 4(т)+ 2HCl (разб.) = ВаCr 2O 7(р)+ ВаCl 2+ Н 2O
Получение: спекание хромита с поташом на воздухе:
4(Cr 2Fe II)O 4+ 8К 2СO 3+ 7O 2= 8К 2CrO 4+ 2Fe 2O 3+ 8СO 2 (1000 °C)
Дихромат калия К 2Cr 2O 7.Оксосоль. Техническое название хромпик. Оранжево-красный, негигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде ( оранжеваяокраска раствора отвечает иону Cr 2O 7 2-). В щелочной среде образует К 2CrO 4. Типичный окислитель в растворе и при сплавлении. Вступает в реакции ионного обмена.
Качественные реакции – синее окрашивание эфирного раствора в присутствии Н 2O 2, синее окрашивание водного раствора при действии атомарного водорода.
Применяется как дубитель кож, протрава при крашении тканей, компонент пиротехнических составов, реагент в аналитической химии, ингибитор коррозии металлов, в смеси с H 2SO 4(конц.) – для мытья химической посуды.
Уравнения важнейших реакций:

6.2. Марганец
Интервал:
Закладка:










