Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
В ряду напряжений натрий стоит значительно левее водорода, из разбавленных кислот HCl и H 2SO 4вытесняет водород (за счет Н 2O и Н +).
Получение натрия в промышленности:
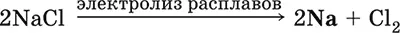
(см. также ниже получение NaOH).
Натрий применяется для получения Na 2O 2, NaOH, NaH, а также в органическом синтезе. Расплавленный натрий служит теплоносителем в ядерных реакторах, а газообразный – используется как наполнитель желтосветных ламп наружного освещения.
Оксид натрия Na 2O. Основный оксид. Белый, имеет ионное строение (Na +) 2O 2-. Термически устойчивый, при прокаливании медленно разлагается, плавится под избыточным давлением пара Na. Чувствителен к влаге и углекислому газу в воздухе. Энергично реагирует с водой (образуется сильнощелочной раствор), кислотами, кислотными и амфотерными оксидами, кислородом (под давлением). Применяется для синтеза солей натрия. Не образуется при сжигании натрия на воздухе.
Уравнения важнейших реакций:
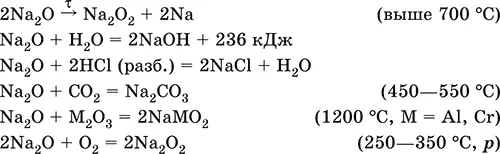
Получение: термическое разложение Na 2O 2(см.), а также сплавление Na и NaOH, Na и Na 2O 2:
2Na + 2NaOH = 2Na aO + H 2 (600 °C)
2Na + Na 2O 2= 2Na aO (130–200 °C)
Пероксид натрия Na 2O 2. Бинарное соединение. Белый, гигроскопичный. Имеет ионное строение (Na +) 2O 2 2-. При нагревании разлагается, плавится под избыточным давлением O 2. Поглощает углекислый газ из воздуха. Полностью разлагается водой, кислотами (выделение O 2при кипячении — качественная реакция на пероксиды). Сильный окислитель, слабый восстановитель. Применяется для регенерации кислорода в изолирующих дыхательных приборах (реакция с СO 2), как компонент отбеливателей ткани и бумаги. Уравнения важнейших реакций:
2Na 2O 2= 2Na 2O + O 2 (400–675 °C, вакуум)
Na 2O 2+ 2Н 2O = Н 2O 2+ 2NaOH (на холоду)
2Na 2O 2+ 2Н 2O = O 2↑ + 4NaOH (кипячение)
Na 2O 2+ 2НCl (разб.) = 2NaCl + Н 2O 2 (на холоду)
2Na 2O 2+ 4НCl (разб.) = 4НCl + 2Н 2O + O 2↑ (кипячение)
2Na 2O 2+ 2CO 2= Na 2CO 3+ O 2
Na 2O 2+ CO = Na 2CO 3
Na 2O 2+ 4H ++ 2I -= I 2↓ + 2H 2O + 2Na +
5Na 2O 2+ 16H ++ 2MnO 4 -= 5O 2↑ + 2Mn 2++ 8H 2O + 10Na +
3Na 2O 2+ 2[Cr(OH) 6] 3-= 2CrO 2 4-+ 8OH -+ 2H 2O + 6Na + (80 °C)
Получение: сжигание Na на воздухе.
Гидроксид натрия NaOH.Основный гидроксид, щелочь, техническое название едкий натр. Белые кристаллы с ионным строением (Na +)(OH -). Расплывается на воздухе, поглощая влагу и углекислый газ (образуется NaHCO 3). Плавится и кипит без разложения. Вызывает тяжелые ожоги кожи и глаз.
Хорошо растворим в воде (с экзо -эффектом, +56 кДж). Реагирует с кислотными оксидами, нейтрализует кислоты, вызывает кислотную функцию у амфотерных оксидов и гидроксидов:
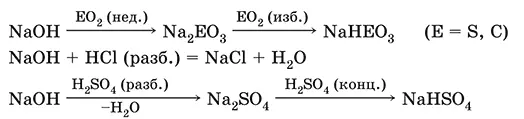
NaOH (разб.) + H 3PO 4(конц.) = NaH 2PO 4+ H 2O
2NaOH (разб.) + H 3PO 4(разб.) = Na 2HPO 4+ 2H 2O
3NaOH (конц.) + H 3PO 4(разб.) = Na 3PO 4+ 3H 2O
2NaOH (T)+ M 2O 3= 2NaMO 2+ H 2O (1000 °C, M = Al, Cr)
2NaOH (конц.) + 3H 2O + AI 2O 3= 2Na[Al(OH) 4] (кипячение)
2NaOH (T)+ M(OH) 2= Na 2MO 2+ 2H 2O (500 °C, M = Be, Zn)
2NaOH (конц.) + Zn(OH) 2= Na 2[Zn(OH) 4]
Осаждает нерастворимые гидроксиды:
2NaOH + MCl 2= 2NaCl + M(OH) 2↓ (M = Mg, Cu)
Подвергает дисмутации галогены и серу:
2NaOH (конц., хол.) + Е 2= NaE + NaEO + H 2O (Е = Cl, Br)
6NaOH (разб., гор.) + 3S = 2Na 2S + Na 2SO 3+ 3H 2O
Подвергается электролизу в расплаве:
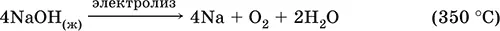
Раствор NaOH разъедает стекло (образуется NaSiO 3), корродирует поверхность алюминия (образуются Na[Al(OH) 4] и Н 2).
Получение NaOH в промышленности:
а) электролиз раствора NaCl на инертном катоде:
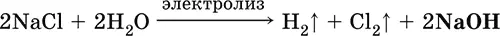
б) электролиз раствора NaCl на ртутном катоде (амальгамный способ):
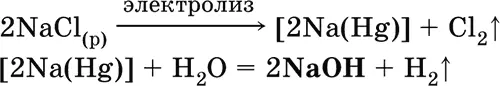
(освобождающуюся ртуть возвращают в электролизер).
Едкий натр – важнейшее сырье химической промышленности. Используется для получения солей натрия, целлюлозы, мыла, красителей и искусственного волокна; как осушитель газов; реагент в извлечении из вторичного сырья и очистке олова и цинка; при переработке руд алюминия (бокситов).
5.2. Калий
Калий – элемент 4-го периода и IA-группы Периодической системы, порядковый номер 19. Электронная формула атома [ 18Ar]4s 1, степени окисления +I и 0. Имеет малую электроотрицательность (0,91), проявляет металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Почти все соли калия хорошо растворимы в воде.
В природе – девятыйпо химической распространенности элемент (шестой среди металлов), находится только в виде соединений. Жизненно важный элемент для всех организмов.
Недостаток калия в почве восполняется внесением калийных удобрений – хлорида КCl, сульфата K 2SO 4и золы растений.
Калий, катион калия и его соединения окрашивают пламя газовой горелки в фиолетовый цвет ( качественное обнаружение).
Калий К.Серебристо-белый металл, легкий, очень мягкий, низкоплавкий. Хранят калий под слоем керосина. С ртутью образует жидкий сплав – амальгаму.
По химическим свойствам похож на натрий, но еще более реакционноспособный. Во влажном воздухе тускнеет, покрываясь гидроксидной пленкой.
Калий проявляет сильные восстановительные свойства. Активно сгорает на воздухе до КO 2, реагирует с водородом (продукт KH), хлором (КCl), серой (K 2S).
Энергично и с высоким экзо -эффектом калий разлагает воду:
2К + 2H 2O = 2KOH + Н 2↑ + 392 кДж,
выделяющийся водород тут же воспламеняется.
В ряду напряжений калий стоит значительно левее водорода, из разбавленных кислот HCl и H 2SO 4вытесняет водород (за счет Н 2O и Н +), при этом серная кислота частично восстанавливается до SO 2.
Получение калия в промышленностиодинаково с получением натрия.
Применяется калий для синтеза его соединений (КO 2, KH, соли), в виде расплава (в смеси с Na) – как теплоноситель в ядерных реакторах.
Гидроксид калия КОН.Основный гидроксид, щёлочь, техническое название едкое кали. Белый, имеет ионное строение К +ОН -. Плавится и кипит без разложения. Расплывается на воздухе, поглощает углекислый газ (образуется КНСO 3). Вызывает тяжелые ожоги кожи и глаз.
Хорошо растворим в воде (с высоким экзо -эффектом), создает в растворе сильнощелочную среду. Нейтрализуется кислотами, реагирует с кислотными оксидами, амфотерными гидроксидами и оксидами. Концентрированный раствор разъедает стекло (образуется K 2SiO 3).
Важнейшие реакции и методы получения КОН в промышленности аналогичны свойствам и получению NaOH.
Читать дальшеИнтервал:
Закладка:










