Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
2М + Г 2= 2МГ (М = Li, Na, К, Rb, Cs, Ag)
M + Г 2= МГ 2 (М = Be, Mg, Са, Sr, Ва, Zn, Mn, Со)
2М + ЗГ 2= 2МГ 3 (М = Al, Ga, Cr)
2М + S = M 2S (М = Li, Na, К, Rb, Cs, Ag)
M + S = MS (M = Be, Mg, Ca, Sr, Ba, Zn, Mn, Fe, Co, Ni)
2M + 3S = M 2S 3 (M = Al, Ga, Cr)
Исключения:
а) Cu и Ni реагируют только с галогенами Cl 2и Br 2(продукты МCl 2, МBr 2)
б) Cr и Mn реагируют с Cl 2, Br 2и I 2(продукты CrCl 3, CrBr 3, CrI 3и MnCl 2, MnBr 2, MnI 2)
в) Fe реагирует с F 2и Cl 2(продукты FeF 3, FeCl 3), с Br 2(смесь FeBr 3и FeBr 2), с I 2(продукт FeI 2)
г) Cu при реакции с S образует смесь продуктов Cu 2S и CuS
Прочие бинарные соединения– все вещества этого класса, кроме выделенных в отдельные подклассы бескислородных кислот и солей.
Способы получения бинарных соединений этого подкласса разнообразны, самый простой – взаимодействие простых веществ (приведены реально протекающие реакции):
а) галогениды:
S + 3F 2= SF 6, N 2+ 3F 2= 2NF 3
2P + 5Г 2= 2РГ 5(Г = F, CI, Br)
С + 2F 2= CF 4
Si + 2Г 2= Sir 4 (Г = F, CI, Br, I)
б) халькогениды:
2As + 3S = As 2S 3
2E + 5S = E 2S 5 (E = P, As)
E + 2S = ES 2 (E = C, Si)
в) нитриды:
3H 2+ N 2 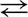 2NH 3
2NH 3
6M + N 2= 2M 3N (M = Li, Na, K)
3M + N 2= M 3N 2 (M = Be, Mg, Ca)
2Al + N 2= 2AlN
3Si + 2N 2= Si 3N 4
г) карбиды:
2M + 2C = M 2C 2 (M = Li, Na)
2Be + С = Be 2C
M + 2C = MC 2 (M = Ca, Sr, Ba)
4Al + 3C = Al 4C 3
Si + С = SiC
д) силициды:
4Li + Si = Li 4Si
2M + Si = M 2Si (M = Mg, Ca)
е) гидриды:
2M + H 2= 2MH (M = Li, Na, K)
M + H 2= MH 2 (M = Mg, Ca)
ж) пероксиды, надпероксиды:
2Na + O 2= Na 2O 2(сгорание на воздухе)
M + O 2= МО 2(М = К, Rb, Cs; сгорание на воздухе)
Многие из этих веществ полностью реагируют с водой (чаще гидролизуются без изменения степеней окисления элементов, но гидриды выступают как восстановители, а надпероксиды вступают в реакции дисмутации):
РCl 5+ 4Н 2O = Н 3РO 4+ 5НCl
SiBr 4+ 2Н 2O = SiO 2↓ + 4НBr
P 2S 5+ 8Н 2O = 2Н 3РO 4+ 5H 2S↑
SiS 2+ 2Н 2O = SiO 2↓ + 2H 2S
Mg 3N 2+ 8H 2O = 3Mg(OH) 2↓ + 2(NH 3H 2O)
Na 3N + 4H 2O = 3NaOH + NH 3H 2O
Be 2C + 4H 2O = 2Be(OH) 2↓ + CH 4↑
MC 2+ 2H 2O = M(OH) 2+ C 2H 2↑ (M = Ca, Sr, Ba)
Al 4C 3+ 12H 2O = 4Al(OH) 3↓ + 3CH 4↑
MH + H 2O = MOH + H 2↑ (M = Li, Na, K)
MgH 2+ 2H 2O = Mg(OH) 2↓ + H 2↑
CaH 2+ 2H 2O = Ca(OH) 2+ H 2↑
Na 2O 2+ 2H 2O = 2NaOH + H 2O 2
2MO 2+ 2H 2O = 2MOH + H 2O 2+ O 2↑ (M = K, Rb, Cs)
Другие вещества, наоборот, устойчивы по отношению к воде, среди них SF 6, NF 3, CF 4, CS 2, AlN, Si 3N 4, SiC, Li 4Si, Mg 2Si и Ca 2Si.
1. Простые вещества – это
1) фуллерен
2) этилен
3) ацетон
4) озон
2. В формульных единицах продуктов реакций
Si + CF1 2→…, Si + O 2→…, Si + Mg →…
общая сумма числа атомов всех элементов равна
1) 8
2) 9
3) 10
4) 11
3. В металлсодержащих продуктах реакций
Na + Н 2O →…, Са + Н 2O →…, Al + НCl (р-р) →…
общая сумма числа атомов всех элементов равна
1) 6
2) 8
3) 10
4) 12
4. Оксид кальция может реагировать (по отдельности) со всеми веществами набора
1) СO 2, NaOH, NO
2) HBr, SO 3, NH 4Cl
3) BaO, SO 3, KMgCl 3
4) O 2, Al 2O 3, NH 3
5. Будет протекать реакция между оксидом серы (IV) и
1) SiO 2
2) КCl
3) LiOH
4) NaNO 3
6. Соль МAlO 2образуется при сплавлении
1) Al и ZnO
2) Al 2O 3и КОН
3) Al и Са(ОН) 2
4) Al 2O 3и Fe 2O 3
7. В молекулярном уравнении реакции
ZnO + HNO 3→ Zn(NO 3) 2+…
сумма коэффициентов равна
1) 4
2) 5
3) 6
4) 7
8. Продукты реакции N 2O 5+ NaOH →… – это
1) Na 2O, HNO 3
2) NaOH, NH 3
3) NaNO 3, H 2O
4) NaNO 2, N 2, H 2O
9. Набор оснований – это
1) NaOH, LiOH, ClOH
2) NaOH, Ba(OH) 2, Cu(OH) 2
3) Ca(OH) 2, KOH, BrOH
4) Mg(OH) 2, Be(OH) 2, NO(OH)
10. Гидроксид калия реагирует в растворе (по отдельности) с веществами набора
1) СО, CuSO 4
2) SO 2, Ag
3) Al, Ba(OH) 2
4) SO 3, FeCl 3
11–12.Остаток, отвечающий кислоте с названием
11. Серная
12. Азотная
имеет формулу
1) NO 2 -
2) SO 4 2-
3) NO 3 -
4) SO 3 2-
13. Из соляной и разбавленной серной кислот не выделяетгаз только металл
1) ртуть
2) цинк
3) магний
4) хром
14. Амфотерный гидроксид – это
1) Ва(ОН) 2
2) CsOH
3) Ni(OH) 2
4) Cr(OH) 3
15-16. По заданным формулам гидроксидов
15. H 3PO 4, РЬ(ОН) 2
16. Cr(OH) 3, HNO 3
выводится формула средней соли
1) РЬ 3(РO 4) 2
2) РЬ 3РO 4
3) Cr 2NO 3
4) Cr(NO 3) 3
17. После пропускания избытка H 2S через раствор гидроксида бария в конечном растворе будет содержаться соль
1) Ba(HS) 2
2) (BaOH) 2S
3) BaS
4) BaSO 3
18. Возможно протекание реакций:
1) CaSO 3+ H 2SO 4 →…
2) Ca(NO 3) 2+ HNO 3 →…
3) NaHCOg + K 2SO 4→…
4) Al(HSO 4) 3+ NaOH →…
19. В уравнении реакции (СаOН) 2СO 3(т) + Н 3РO 4→ СаНРO 4↓ +…
сумма коэффициентов равна
1) 6
2) 5
3) 9
4) 8
20. Установите соответствие между формулой вещества и группой, к которой оно относится.

21. Установите соответствие между исходными веществами и продуктами реакций.

22. В схеме превращений
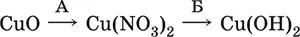
вещества А и Б указаны в наборе
1) NaNO 3, Н 2O
2) HNO3, КОН
3) N 2O, NaOH
4) HNO 3, Н 2O
23. Составьте уравнения возможных реакций по схеме
FeS → H 2S + PbS → PbSO 4→ Pb(HSO 4) 2
24. Составьте уравнения четырех возможных реакций между веществами:
1) азотная кислота (конц.)
2) углерод (графит или кокс)
3) оксид кальция
4) оксид железа(II)
5. Металлы главных подгрупп I–III групп
5.1. Натрий
Натрий – элемент 3-го периода и IA-группы Периодической системы, порядковый номер 11. Электронная формула атома [ 10Ne]3s 1, степени окисления +I и 0. Имеет малую электроотрицательность (0,93), проявляет только металлические (основные) свойства. Образует (как катион) многочисленные соли и бинарные соединения. Почти все соли натрия хорошо растворимы в воде.
В природе – пятыйпо химической распространенности элемент (второй среди металлов), встречается только в виде соединений. Жизненно важный элемент для всех организмов.
Натрий, катион натрия и его соединения окрашивают пламя газовой горелки в ярко-желтый цвет ( качественное обнаружение).
Натрий Na. Серебристо-белый металл, легкий, мягкий (режется ножом), низкоплавкий. Хранят натрий в керосине. С ртутью образует жидкий сплав — амальгаму (до 0,2 % Na).
Весьма реакционноспособный, во влажном воздухе натрий медленно покрывается гидроксидной пленкой и теряет блеск (тускнеет):
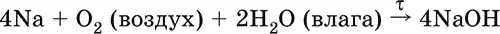
Натрий химически активен, сильный восстановитель. Воспламеняется на воздухе при умеренном нагревании (>250 °C), реагирует с неметаллами:
2Na + O 2= Na 2O 22Na + H 2= 2NaH
2Na + Cl 2= 2NaCl 2Na + S = Na 2S
6Na + N 2= 2Na 3N 2Na + 2C = Na 2C 2
Очень бурно и с большим экзо -эффектом натрий реагирует с водой:
2Na + 2H 2O = 2NaOH + Н 2↑ + 368 кДж
От теплоты реакции кусочки натрия расплавляются в шарики, которые начинают беспорядочно двигаться из-за выделения Н 2. Реакция сопровождается резкими щелчками вследствие взрывов гремучего газа (Н 2+ O 2). Раствор окрашивается фенолфталеином в малиновый цвет (щелочная среда).
Читать дальшеИнтервал:
Закладка:










