Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Химические связи существуют не только внутри молекул веществ, но могут образовываться и между молекулами, например для жидкого HF, воды Н 2O и смеси H 2O + NH 3:
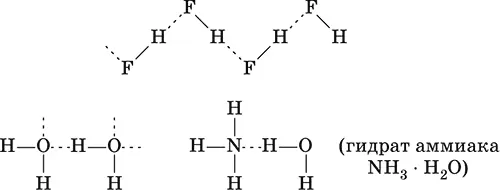
Водородная связь образуется за счет сил электростатического притяжения полярных молекул, содержащих атомы самых электроотрицательных элементов – F, О, N. Например, водородные связи имеются в HF, Н 2O и NH 3, но их нет в HCl, H 2S и РН 3.
Водородные связи малоустойчивы и разрываются довольно легко, например при плавлении льда и кипении воды. Однако на разрыв этих связей затрачивается некоторая дополнительная энергия, и поэтому температуры плавления (табл. 5) и кипения веществ с водородными связями
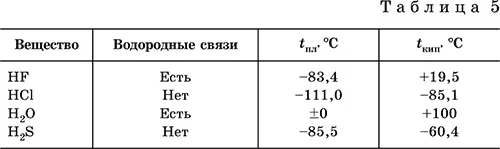
(например, HF и Н 2O) оказываются значительно выше, чем у подобных веществ, но без водородных связей (например, HCl и H 2S соответственно).
Многие органические соединения также образуют водородные связи; важную роль водородная связь играет в биологических процессах.
1. Вещества только с ковалентными связями – это
1) SiH 4, Сl 2O, СаВr 2
2) NF 3, NH 4Cl, P 2O 5
3) CH 4, HNO 3, Na(CH 3O)
4) CCl 2O, I 2, N 2O
2–4.Ковалентная связь
2. одинарная
3. двойная
4. тройная
присутствует в веществе
1) КСl
2) N 2
3) S 2
4) H 2S
5. Кратные связи имеются в молекулах
1) HCOOH
2) ССl 4
3) С 3Н 8
4) С 3Н 4
6. Частицы, называемые радикалами, – это
1) SO 2
2) СlO 2
3) С 2Н 6
4) С 2Н 5
7. Одна из связей образована по донорно-акцепторному механизму в наборе ионов
1) SO 4 2-, NH 4 +
2) H 3O +, NH 4 +
3) PO 4 3-, NO 3 -
4) PH 4 +, SO 3 2-
8. Наиболее прочнаяи короткаясвязь – в молекуле
1) Н 2O
2) H 2S
3) HF
4) PH 3
9. Вещества только с ионными связями – в наборе
1) HCl, КСl
2) NH 4Cl, SiCl 4
3) NaF, CsCl
4) Nal, P 2O 5
10–13.Кристаллическая решетка вещества
10. Si
11. H 2SO 4
12. Cr
13. Ва(ОН) 2
1) металлическая
2) ионная
3) атомная
4) молекулярная
4. Классификация и взаимосвязь неорганических веществ
Классификация неорганических веществ базируется на химическом составе – наиболее простой и постоянной во времени характеристике. Химический состав вещества показывает, какие элементы присутствуют в нем и в каком числовом отношении для их атомов.
Элементыусловно делятся на элементы с металлическими и неметаллическими свойствами. Первые из них всегда входят в состав катионовмногоэлементных веществ (металлические свойства), вторые – в состав анионов (неметаллические свойства). В соответствии с Периодическим законом в периодах и группах между этими элементами находятся амфотерные элементы, проявляющие одновременно в той или иной мере металлические и неметаллические (амфотерные, двойственные) свойства. Элементы VIIIA-группы продолжают рассматривать отдельно (благородные газы), хотя для Kr, Хе и Rn обнаружены явно неметаллические свойства (элементы Не, Ne, Ar химически инертны).
Классификация простых и сложных неорганических веществ приведена в табл. 6.
Ниже приводятся определения (дефиниции) классов неорганических веществ, их важнейшие химические свойства и способы получения.
Неорганические вещества– соединения, образуемые всеми химическими элементами (кроме большинства органических соединений углерода). Делятся по химическому составу:

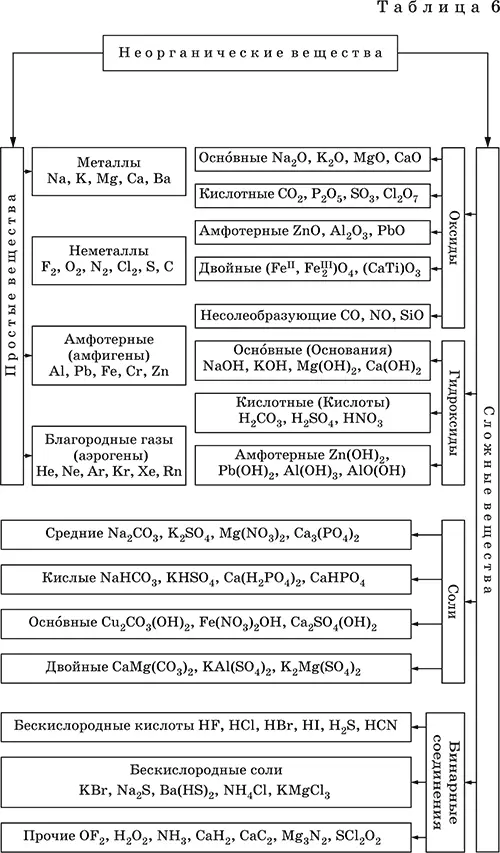
Простые веществаобразованы атомами одного элемента. Делятся по химическим свойствам:

Металлы– простые вещества элементов с металлическими свойствами (низкая электроотрицательность). Типичные металлы:
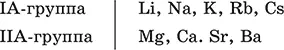
Металлы обладают высокой восстановительной способностью по сравнению с типичными неметаллами. В электрохимическом ряду напряжений они стоят значительно левее водорода, вытесняют водород из воды (магний – при кипячении):

Простые вещества элементов Cu, Ag и Ni также относят к металлам, так как у их оксидов CuO, Ag 2O, NiO и гидроксидов Cu(OH) 2, Ni(OH) 2преобладают основные свойства.
Неметаллы– простые вещества элементов с неметаллическими свойствами (высокая электроотрицательность). Типичные неметаллы: F 2, Cl 2, Br 2, I 2, O 2, S, N 2, Р, С, Si.
Неметаллы обладают высокой окислительной способностью по сравнению с типичными металлами.
Амфигены– амфотерные простые вещества, образованные элементами с амфотерными (двойственными) свойствами (электроотрицательность промежуточная между металлами и неметаллами). Типичные амфигены: Be, Cr, Zn, Аl, Sn, Pb.
Амфигены обладают более низкой восстановительной способностью по сравнению с типичными металлами. В электрохимическом ряду напряжений они примыкают слева к водороду или стоят за ним справа.
Аэрогены– благородные газы, одноатомные простые вещества элементов VIIIA-группы: Не, Ne, Ar, Kr, Xe, Rn. Из них He, Ne и Ar химически пассивны (соединения с другими элементами не получены), а Kr, Хе и Rn проявляют некоторые свойства неметаллов с высокой электроотрицательностью.
Сложные веществаобразованы атомами разных элементов. Делятся по составу и химическим свойствам:
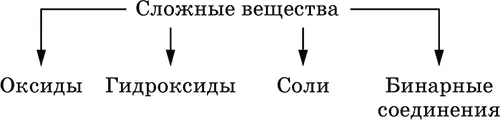
Оксиды– соединения элементов с кислородом, степень окисления кислорода в оксидах всегда равна (-II). Делятся по составу и химическим свойствам:
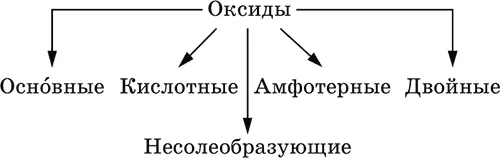
Элементы He, Ne и Ar соединений с кислородом не образуют. Соединения элементов с кислородом в других степенях окисления – это не оксиды, а бинарные соединения, например O +IIF 2 -Iи H 2 +IO 2 -I. Не относятся к оксидам и смешанные бинарные соединения, например S +IVCl 2 -IO -II.
Оснóвные оксиды– продукты полной дегидратации (реальной или условной) основных гидроксидов, сохраняют химические свойства последних.
Читать дальшеИнтервал:
Закладка:










