Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Если средние соли получают по реакциям с участием гидроксидов, то реагенты берут в эквивалентных количествах. Например, соль К 2СO 3можно получить, если взять реагенты в соотношениях:
2КОН и 1Н 2СO 3, 1К 2O и 1Н 2СO 3, 2КОН и 1СO 2.
Реакции образования средних солей:
1)
1а) основный гидроксид + кислотный гидроксид →…
2NaOH + H 2SO 4= Na 2SO 4+ 2Н 2O
Cu(OH) 2+ 2HNO 3= Cu(NO 3) 2+ 2H 2O
1б) амфотерный гидроксид + кислотный гидроксид →…
2Al(ОН) 3+ 3H 2SO 4= Al 2(SO 4) 3+ 6Н 2O
Zn(OH) 2+ 2HNO 3= Zn(NO 3) 2+ 2Н 2O
1в) основный гидроксид + амфотерный гидроксид →…
NaOH + Al(ОН) 3= NaAlO 2+ 2Н 2O (в расплаве)
2NaOH + Zn(OH) 2= Na 2ZnO 2+ 2Н 2O (в расплаве)
2)
2а) основный оксид + кислотный гидроксид →…
Na 2O + H 2SO 4= Na 2SO 4+ Н 2O
CuO + 2HNO 3= Cu(NO 3) 2+ H 2O
2б) амфотерный оксид + кислотный гидроксид →…
Al 2O 3+ 3H 2SO 4= Al 2(SO 4) 3+ 3H 2O
ZnO + 2HNO 3= Zn(NO 3) 2+ H 2O
2в) основный оксид + амфотерный гидроксид →…
Na 2O + 2Al(ОН) 3= 2NaAlO 2+ ЗН 2O (в расплаве)
Na 2O + Zn(OH) 2= Na 2ZnO 2+ Н 2O (в расплаве)
3)
За) основный гидроксид + кислотный оксид →…
2NaOH + SO 3= Na 2SO 4+ Н 2O
Ва(ОН) 2+ СO 2= ВаСO 3+ Н 2O
3б) амфотерный гидроксид + кислотный оксид →…
2Al(ОН) 3+ 3SO 3= Al 2(SO 4) 3+ 3H 2O
Zn(OH) 2+ N 2O 5= Zn(NO 3) 2+ H 2O
Зв) основный гидроксид + амфотерный оксид →…
2NaOH + Al 2O 3= 2NaAlO 2+ Н 2O (в расплаве)
2NaOH + ZnO = Na 2ZnO 2+ Н 2O (в расплаве)
4)
4а) основный оксид + кислотный оксид →…
Na 2O + SO 3= Na 2SO 4, BaO + СO 2= ВаСO 3
4б) амфотерный оксид + кислотный оксид →…
Al 2O 3+ 3SO 3= Al 2(SO 4) 3, ZnO + N 2O 5= Zn(NO 3) 2
4в) основный оксид + амфотерный оксид →…
Na 2O + Al 2O 3= 2NaAlO 2, Na 2O + ZnO = Na 2ZnO 2
Реакции 1в, если они протекают в растворе, сопровождаются образованием других продуктов — комплексных солей:
NaOH (конц.) + Al(OН) 3= Na[Al(OH) 4]
КОН (конц.) + Cr(OH) 3= К 3[Cr(ОН) 6]
2NaOH (конц.) + M(OH) 2= Na 2[M(OH) 4] (М = Be, Zn)
КОН (конц.) + M(OH) 2= K[M(OH) 3] (М = Sn, Pb)
Все средние соли в растворе – сильные электролиты (диссоциируют нацело).
Кислые солисодержат кислые кислотные остатки (с водородом) HCO 3 -, Н 2РO 4 2-, HPO 4 2-и др., образуются при действии на основные и амфотерные гидроксиды или средние соли избытка кислотных гидроксидов, содержащих не менее двух атомов водорода в молекуле; аналогично действуют соответствующие кислотные оксиды:
NaOH + H 2SO 4(конц.) = NaHSO 4+ H 2O
Ва(ОН) 2+ 2Н 3РO 4(конц.) = Ва(Н 2РO 4) 2+ 2Н 2O
Zn(OH) 2+ Н 3РO 4(конц.) = ZnHPO 4↓ + 2Н 2O
PbSO 4+ H 2SO 4(конц.) = Pb(HSO 4) 2
K 2HPO 4+ Н 3РO 4(конц.) = 2КН 2РO 4
Са(ОН) 2+ 2ЕO 2= Са(НЕO 3) 2(Е = С, S)
Na 2EO 3+ ЕO 2+ H 2O = 2NaHEO 3(Е = С, S)
При добавлении гидроксида соответствующего металла или амфигена кислые соли переводятся в средние:
NaHSO 4+ NaOH = Na 2SO 4+ Н 2O
Pb(HSO 4) 2+ Pb(OH) 2= 2PbSO 4↓ + 2H 2O
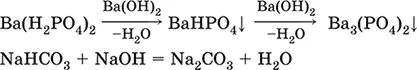
Почти все кислые соли хорошо растворимы в воде, диссоциируют нацело (КНСO 3= К ++ HCO 3 -).
Оснóвные солисодержат гидроксогруппы ОН, рассматриваемые как отдельные анионы, например FeNO 3(OH), Ca 2SO 4(OH) 2, Cu 2CO 3(OH) 2, образуются при действии на кислотные гидроксиды избыткаосновного гидроксида, содержащего не менее двух гидроксогрупп в формульной единице:
Со(ОН) 2+ HNO 3= CoNO 3(OH)↓ + Н 2O
2Ni(OH) 2+ H 2SO 4= Ni 2SO 4(OH) 2↓ + 2H 2O
2Cu(OH) 2+ H 2CO 3= Cu 2CO 3(OH) 2↓ + 2H 2O
Основные соли, образованные сильными кислотами, при добавлении соответствующего кислотного гидроксида переходят в средние:
CoNO 3(OH) + HNO 3= Co(NO 3) 2+ Н 2O
Ni 2SO 4(OH) 2+ H 2SO 4= 2NiSO 4+ 2H 2O
Большинство основных солей малорастворимы в воде; они осаждаются при совместном гидролизе, если образованы слабыми кислотами:
2MgCl 2+ Н 2O + 2Na 2CO 3= Mg 2CO 3(OH) 2↓ + СO 2↑ + 4NaCl
Двойные солисодержат два химически разных катиона; например: CaMg(CO 3) 2, KAl(SO 4) 2, Fe(NH 4) 2(SO 4) 2, LiAl(SiO 3) 2. Многие двойные соли образуются (в виде кристаллогидратов) при совместной кристаллизации соответствующих средних солей из насыщенного раствора:
K 2SO 4+ MgSO 4+ 6Н 2O = K 2Mg(SO 4) 26Н 2O↓
Часто двойные соли менее растворимы в воде по сравнению с отдельными средними солями.
Бинарные соединения– это сложные вещества, не относящиеся к классам оксидов, гидроксидов и солей и состоящие из катионов и бескислородных анионов (реальных или условных).
Их химические свойства разнообразны и рассматриваются в неорганической химии отдельно для неметаллов разных групп Периодической системы; в этом случае классификация проводится по виду аниона.
Примеры:
а) галогениды: OF 2, HF, KBr, PbI 2, NH 4Cl, BrF 3, IF 7
б) хальгогениды: H 2S, Na 2S, ZnS, As 2S 3, NH 4HS, K 2Se, NiSe
в) нитриды: NH 3, NH 3H 2O, Li 3N, Mg 3N 2, AlN, Si 3N 4
г) карбиды: CH 4, Be 2C, Al 4C 3, Na 2C 2, CaC 2, Fe 3C, SiC
д) силициды: Li 4Si, Mg 2Si, ThSi 2
е) гидриды: LiH, CaH 2, AlH 3, SiH 4
ж) пероксидьг. H 2O 2, Na 2O 2, СаO 2
з) надпероксиды: HO 2, КO 2, Ва(O 2) 2
По типу химической связи среди этих бинарных соединений различают:
ковалентные: OF 2, IF 7, H 2S, P 2S 5, NH 3, H 2O 2
ионные: Nal, K 2Se, Mg 3N 2, CaC 2, Na 2O 2, KO 2
Встречаются двойные(с двумя разными катионами) и смешанные(с двумя разными анионами) бинарные соединения, например: KMgCl 3, (FeCu)S 2и Pb(Cl)F, Bi(Cl)O, SCl 2O 2, As(O)F 3.
Все ионные комплексные соли (кроме гидроксокомплексных) также относятся к этому классу сложных веществ (хотя обычно рассматриваются отдельно), например:
[Cu(NH 3) 4]SO 4K 4[Fe(CN) 6] Na 3[AlF 6]
[Ag(NH 3) 2]Cl K 3[Fe(NCS) 6] K 2[SiF 6]
К бинарным соединениям относятся ковалентные комплексные соединения без внешней сферы, например [Fe(CO) 5] и [№(СО) 4].
По аналогии со взаимосвязью гидроксидов и солей из всех бинарных соединений выделяют бескислородные кислоты и соли (остальные соединения классифицируют как прочие).
Бескислородные кислотысодержат (как и оксокислоты) подвижный водород Н +и поэтому проявляют некоторые химические свойства кислотных гидроксидов (диссоциация в воде, участие в реакциях солеобразования в роли кислоты). Распространенные бескислородные кислоты – это HF, НCl, HBr, HI, HCN и H 2S, из них HF, HCN и H 2S – слабые кислоты, а остальные – сильные.
Примерыреакций солеобразования:
2HBr + ZnO = ZnBr 2+ Н 2O
2H 2S + Ва(ОН) 2= Ba(HS) 2+ 2Н 2O
2HI + Pb(OH) 2= Pbl 2↓ + 2Н 2O
Металлы и амфигены, стоящие в ряду напряжений левее водорода и не реагирующие с водой, вступают во взаимодействие с сильными кислотами НCl, НВr и HI (в общем виде НГ) в разбавленном растворе и вытесняют из них водород (приведены реально протекающие реакции):
М + 2НГ = МГ 2+ Н 2↑ (М = Be, Mg, Zn, Cr, Mn, Fe, Co, Ni)
2M + 6НГ = 2МГ 3+ H 2↑ (M = Al, Ga)
Бескислородные солиобразованы катионами металлов и амфигенов (а также катионом аммония NH 4 +) и анионами (остатками) бескислородных кислот; примеры: AgF, NaCl, KBr, PbI 2, Na 2S, Ba(HS) 2, NaCN, NH 4Cl. Проявляют некоторые химические свойства оксосолей.
Общий способ получения бескислородных солей с одноэлементными анионами – взаимодействие металлов и амфигенов с неметаллами F 2, Cl 2, Br 2и I 2(в общем виде Г 2) и серой S (приведены реально протекающие реакции):
Читать дальшеИнтервал:
Закладка:










