Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Из типичных металлов только Li, Mg, Ca и Sr образуют оксиды Li 2O, MgO, СаО и SrO при сжигании на воздухе; оксиды Na 2O, К 2O, Rb 2O, Cs 2O и ВаО получают другими способами.
Оксиды CuO, Ag 2O и NiO также относят к основным.
Кислотные оксиды– продукты полной дегидратации (реальной или условной) кислотных гидроксидов, сохраняют химические свойства последних.
Из типичных неметаллов только S, Se, Р, As, С и Si образуют оксиды SO 2, SeO 2, Р 2O 5, As 2O 3, СO 2и SiO 2при сжигании на воздухе; оксиды Cl 2O, Cl 2O 7, I 2O 5, SO 3, SeO 3, N 2O 3, N 2O 5и As 2O 5получают другими способами.
Исключение: у оксидов NO 2и ClO 2нет соответствующих кислотных гидроксидов, но их считают кислотными, так как NO 2и ClO 2реагируют со щелочами, образуя соли двух кислот, а ClO 2и с водой, образуя две кислоты:
а) 2NO 2+ 2NaOH = NaNO 2+ NaNO 3+ H 2O
б) 2ClO 2+ Н 2O (хол.) = НClO 2+ НClO 3
2ClO 2+ 2NaOH (хол.) = NaClO 2+ NaClO 3+ H 2O
Оксиды CrO 3и Mn 2O 7(хром и марганец в высшей степени окисления) также являются кислотными.
Амфотерные оксиды– продукты полной дегидратации (реальной или условной) амфотерных гидроксидов, сохраняют химические свойства амфотерных гидроксидов.
Типичные амфигены (кроме Ga) при сжигании на воздухе образуют оксиды BeO, Cr 2O 3, ZnO, Al 2O 3, GeO 2, SnO 2и РЬО; амфотерные оксиды Ga 2O 3, SnO и РЬO 2получают другими способами.
Двойные оксидыобразованы либо атомами одного амфотерного элемента в разных степенях окисления, либо атомами двух разных (металлических, амфотерных) элементов, что и определяет их химические свойства. Примеры:
(Fe IIFe 2 III)O 4, (Рb 2 IIPb IV)O 4, (MgAl 2)O 4, (CaTi)O 3.
Оксид железа образуется при сгорании железа на воздухе, оксид свинца – при слабом нагревании свинца в кислороде; оксиды двух разных металлов получают другими способами.
Несолеобразующие оксиды– оксиды неметаллов, не имеющие кислотных гидроксидов и не вступающие в реакции солеобразования (отличие от основных, кислотных и амфотерных оксидов), например: СО, NO, N 2O, SiO, S 2O.
Гидроксиды– соединения элементов (кроме фтора и кислорода) с гидроксогруппами О -IIН, могут содержать также кислород O -II. В гидроксидах степень окисления элемента всегда положительная (от +I до +VIII). Число гидроксогрупп от 1 до 6. Делятся по химическим свойствам:
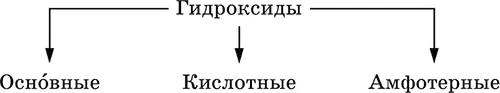
Оснóвные гидроксиды (основания)образованы элементами с металлическими свойствами.
Получаются по реакциям соответствующих основных оксидов с водой:
М 2O + Н 2O = 2МОН (М = Li, Na, К, Rb, Cs)
МО + Н 2O = М(ОН) 2 (М = Са, Sr, Ва)
Исключение: гидроксиды Mg(OH) 2, Cu(OH) 2и Ni(OH) 2получают другими способами.
При нагревании реальная дегидратация (потеря воды) протекает для следующих гидроксидов:
2LiOH = Li 2O + Н 2O
М(ОН) 2= МО + Н 2O (М = Mg, Са, Sr, Ва, Cu, Ni)
Основные гидроксиды замещают свои гидроксогруппы на кислотные остатки с образованием солей, металлические элементы сохраняют свою степень окисления в катионах солей.
Хорошо растворимые в воде основные гидроксиды (NaOH, КОН, Са(ОН) 2, Ва(ОН) 2и др.) называют щелочами, так как именно с их помощью в растворе создается щелочная среда.
Кислотные гидроксиды (кислоты)образованы элементами с неметаллическими свойствами. Примеры:
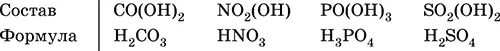
При диссоциации в разбавленном водном растворе образуются катионы Н +(точнее, Н 3O +) и следующие анионы, или кислотные остатки:
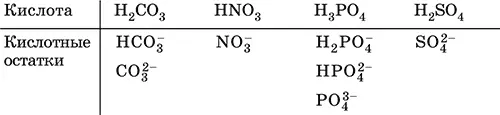
Кислоты можно получить по реакциям соответствующих кислотных оксидов с водой (ниже приведены реально протекающие реакции):
Cl 2O + H 2O = 2HClO
Е 2O 3+ Н 2O = 2НЕO 2(Е = N, As)
As 2O 3+ 3H 2O = 2H 3AsO 3
EO 2+ H 2O = H 2EO 3(Е = С, Se)
E 2O 5+ H 2O = 2HEO 3(Е = N, Р, I)
E 2O 5+ 3H 2O = 2H 3EO 4(E = P, As)
EO 3+ H 2O = H 2EO 4(E = S, Se, Cr)
E 2O 7+ H 2O = 2HEO 4(E = Cl, Mn)
Исключение: оксиду SO 2в качестве кислотного гидроксида соответствует полигидрат SO 2 n Н 2O («сернистая кислота H 2SO 3» не существует, но кислотные остатки HSO 3 -и SO 3 2-присутствуют в солях).
При нагревании некоторых кислот протекает реальная дегидратация и образуются соответствующие кислотные оксиды:
2HAsO 2= As 2O 3+ H 2O
H 2EO 3= EO 2+ H 2O (E = C, Si, Ge, Se)
2HIO 3= I 2O 5+ H 2O
2H 3AsO 4= As 2O 5+ H 2O
H 2SeO 4= SeO 3+ H 2O
При замене (реальной и формальной) водорода кислот на металлы и амфигены образуются соли, кислотные остатки сохраняют в солях свой состав и заряд. Кислоты H 2SO 4и Н 3РO 4в разбавленном водном растворе реагируют с металлами и амфигенами, стоящими в ряду напряжений левее водорода, при этом образуются соответствующие соли и выделяется водород (кислота HNO 3в такие реакции не вступает; ниже типичные металлы, кроме Mg, не указаны, так как они реагируют в подобных условиях с водой):
М + H 2SO 4(pasб.) = MSO 4+ Н 2↑ (М = Be, Mg, Cr, Mn, Zn, Fe, Ni)
2M + 3H 2SO 4(paзб.) = M 2(SO 4) 3+ 3H 2↑ (M = Al, Ga)
3M + 2Н 3РO 4(разб.) = M 3(PO 4) 2↓ + 3H 2↑ (M = Mg, Fe, Zn)
В отличие от бескислородных кислот кислотные гидроксиды называют кислородсодержащими кислотами или оксокислотами.
Амфотерные гидроксидыобразованы элементами с амфотерными свойствами. Типичные амфотерные гидроксиды:
Be(OH) 2Sn(OH) 2Al(OH) 3AlO(OH)
Zn(OH) 2Pb(OH) 2 Cr(OH) 3CrO(OH)
He образуются из амфотерных оксидов и воды, но подвергаются реальной дегидратации и образуют амфотерные оксиды:
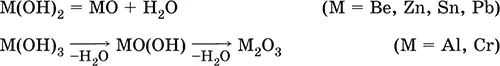
Исключение: для железа(III) известен только метагидроксид FeO(OH), «гидроксид железа(III) Fe(OH) 3» не существует (не получен).
Амфотерные гидроксиды проявляют свойства основных и кислотных гидроксидов; образуют два вида солей, в которых амфотерный элемент входит в состав либо катионов солей, либо их анионов.
Для элементов, имеющих несколько степеней окисления, действует правило: чем выше степень окисления, тем более выражены кислотные свойства гидроксидов (и/или соответствующих оксидов).
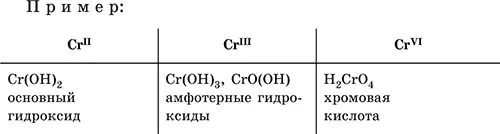
Соли– соединения, состоящие из катионовосновных или амфотерных (в роли основных) гидроксидов и анионов(остатков) кислотных или амфотерных (в роли кислотных) гидроксидов. В отличие от бескислородных солей, соли, рассматриваемые здесь, называются кислородсодержащими солями или оксосолями. Делятся по составу катионов и анионов:
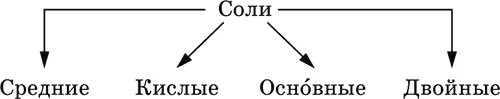
Средние солисодержат средние кислотные остатки СО 3 2-, NO 3 -, РО 4 3-, SO 4 2-и др.; например: К 2СO 3, Mg(NO 3) 2, Cr 2(SO 4) 3, Zn 3(PO 4) 2.
Читать дальшеИнтервал:
Закладка:










