Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
5.5. Алюминий
Алюминий – элемент 3-го периода и IIIA-группы Периодической системы, порядковый номер 13. Электронная формула атома [ 10Ne]3s 23p 1, степени окисления + III и 0.
По электроотрицательности (1,47) одинаков с бериллием, проявляет амфотерные (кислотные и основные) свойства. В соединениях может находиться в составе катионов и анионов.
В природе – четвертыйпо химической распространенности элемент (первый среди металлов), находится в химически связанном состоянии.
Алюминий Al. Серебристо-белый, блестящий, легкий и пластичный металл. На воздухе покрывается матовой защитной пленкой Al 2O 3, весьма устойчивой и защищающей металл от коррозии; пассивируется в воде и концентрированной HNO 3(образование той же оксидной пленки).
Реакционноспособный, сгорает на воздухе, при комнатной температуре реагирует с галогенами Cl 2, Br 2и I 2, при нагревании – с фтором, серой:
4Al(порошок) + 3O 2(воздух) = 2Al 2O 3 (700 °C)
2Al(порошок) + ЗЕ 2= 2AlЕ 3 (25 °C, Е = CI, Br)
2Al(порошок) + 3I 2= 2AlI 3 (25 °C, кат. – капля Н 2O)
2Al + 3F 2= 2AlF 3 (600 °C)
2Al + 3S = Al 2S 3 (150–200 °C)
Алюминий восстанавливает другие металлы из их оксидов (промышленно важный метод — алюминотермия):
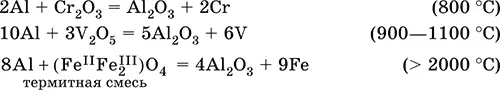
Амальгамированный алюминий, т. е. очищенный от оксидной пленки, энергично и с большим экзо -эффектом реагирует с водой:
2Al + 6Н 2O = 2Al(ОН) 3↓ + ЗН 2↑ + 836 кДж
Алюминий – сильный (типичный) восстановитель, в ряду напряжений стоит значительно левее водорода; вытесняет водород из разбавленных кислот НCl и H 2SO 4:
2Al + 6Н+ = 2Al 3++ ЗН 2↑
и, проявляя амфотерность, из концентрированного раствора щелочей (окислитель – вода):
2Al + 2NaOH + 6Н 2O = 2Na[Al(OH) 4] + ЗН 2↑ (80 °C)
Реагирует со щелочами в расплаве (также демонстрируя амфотерные свойства):
2Al + 6NaOH (T)= 2NaAlO 2+ ЗН 2+ 2Na 2O (450 °C)
Взаимодействует с разбавленнойазотной кислотой:
Al + 4НNO 3(разб.) = Al(NO 3) 3+ NO↑ + 2Н 2O
и восстанавливает N vдо N -IIIв реакциях с очень разбавленнойазотной кислотой и ее солями:
8Al + З0НNO 3(оч. разб.) = 8Al(NO 3) 3+ 3NH 4NO 3+ 9Н 2O
8Al + 18Н 2O + 5КОН + 3KNO 3= 8К[Al(ОН) 4] + 3NH 3↑ (кипячение)
(движущей силой этих реакций служит промежуточное выделение атомарного водорода Н 0, а во второй реакции – также и образование устойчивого гидроксокомплекса [Al(OH),] -).
Получение алюминия в промышленности– электролиз Al 2O 3в расплаве криолита Na 3[AlF 6] при 950 °C:
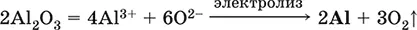
Применяется как реагент в алюминотермии для получения редких металлов и термитной сварке стальных конструкций. Алюминий – важнейший конструкционный материал, основа легких коррозионно-стойких сплавов (с магнием — дуралюмин, или дюраль, с медью — желтая алюминиевая бронза, из которой чеканят мелкую разменную монету). Чистый алюминий в больших количествах идет на изготовление посуды и электрических проводов.
Оксид алюминия Al 2O 3.Амфотерный оксид, кислотные и основные свойства равно выражены. Белый, имеет ионное строение (Al 3+) 2(O 2-) 3. Тугоплавкий, термически устойчивый. Аморфный порошок гигроскопичен и химически активен, кристаллический – очень тверд и химически пассивен. Не реагирует с водой, разбавленными кислотами и щелочами. Переводится в раствор концентрированными кислотами и щелочами, реагирует со щелочами и карбонатом натрия при сплавлении. Применяется как сырье в производстве алюминия, для изготовления огнеупорных, химически стойких и абразивных материалов, особо чистый Al 2O 3– для изготовления рубиновых лазеров и синтетических драгоценных камней (рубины, сапфиры и др.), окрашенных примесями оксидов других металлов – Cr 2O 3(красный цвет), Ti 2O 3и Fe 2O 3(голубой цвет).
Уравнения важнейших реакций:
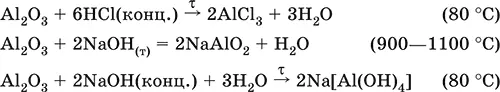
(эта реакция используется для «вскрытия» бокситов)
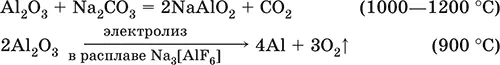
В природе входит в состав глины и бокситов, образует минерал корунд.
Гидроксид алюминия Al(ОН) 3.Амфотерный гидроксид, кислотные и основные свойства равно выражены. Белый, аморфный (гелеобразный) или кристаллический. Связи Al – ОН преимущественно ковалентные. Разлагается при нагревании без плавления. Практически не растворяется в воде. Реагирует с кислотами, щелочами в растворе и при сплавлении. Не реагирует с NH 3Н 2O, NH 4Cl, СO 2, SO 2и H 2S. Метагидроксид АlO(ОН) химически менее активен, чем Al(ОН) 3. Промежуточный продукт в производстве алюминия. Применяется для синтеза других соединений алюминия (в том числе криолита), органических красителей, как лекарственный препарат при повышенной кислотности желудочного сока.
Уравнения важнейших реакций:
• термическое разложение
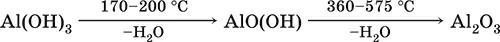
• основная и кислотная диссоциация в растворе
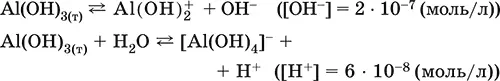
(реакции характеризуют очень малую растворимость в воде и амфотерность гидроксида, поставляющего в раствор одновременно ионы ОН и Н +примерно в равной концентрации; гидроксид диссоциирует слабее, чем сама вода)
• амфотерные свойства
Al(ОН) 3+ ЗНСlразб.) = AlCl 3+ ЗН 2O
Al(ОН) 3+ NaOH (т)= NaAlO 2+ 2Н 2O (1000 °C)
Al(ОН) 3+ NaOH(конц.) = Na[Al(OH) 4] (p)
Для получения осадка Al(ОН) 3щелочь обычно не используют из-за легкости перехода осадка в раствор (см. выше), а действуют на соли алюминия гидратом аммиака. При комнатной температуре образуется Al(ОН) 3, а при кипячении – менее активный АlO(ОН):
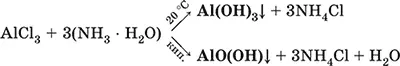
Удобный способ получения Al(ОН) 3– пропускание СO 2через раствор гидроксокомплекса:
[Al(ОН) 4] -+ СO 2= Al(ОН) 3↓ +HCO 3 -
Тетрагидроксоалюминат(III) натрия Na[Al(OH) 4].Комплексная соль. С таким составом существует при комнатной температуре в концентрированном растворе NaOH. Для твердого состояния состав условный, так как при кристаллизации из раствора он усложняется (выделены Na 4[Al(OH) 7], Na 4[Al 4O 3(OH) 10] и др.). При прокаливании твердые соли разлагаются до диоксоалюмината(III) натрия NaAlO 2, при разбавлении их растворов – до Al(ОН) 3. По-разному реагируют с сильными и слабыми кислотами, с хлоридом алюминия и карбонатом аммония.
Уравнения важнейших реакций:
Читать дальшеИнтервал:
Закладка:










