Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
2) ослабевает
3) не изменяется
4) не знаю
7. Неметаллы главных подгрупп IV–VII групп
7.1. Водород
Водород – первый элемент Периодической системы (1-й период, порядковый номер 1). Не имеет полной аналогии с остальными химическими элементами и не принадлежит ни к какой группе (в таблицах условно помещается в IA– и/или в VIIA-группу).
Атом водорода наименьший по размерам и самый легкий среди атомов всех элементов. Электронная формула атома 1s 1, характерные степени окисления 0, +I и реже – I. Состояние H Iсчитается устойчивым (соединения с H -I– сильные восстановители).
Шкала степеней окисления водорода:
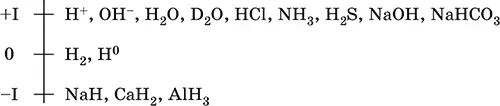
По электроотрицательности (2,10) водород занимает промежуточное положение между типичными металлами и типичными неметаллами. Проявляет амфотерные свойства – металлические и неметаллические. Входит в состав катионов (катионы оксония Н 3O +и аммония NH 4+, аквакатионы металлов) и многочисленных анионов – кислыхкислотных остатков (HS -, HCO 3 -и др.).
Природный водород содержит изотоп 1Н — протий с примесью стабильного изотопа 2H(D) – дейтерия и следами радиоактивного изотопа 3Н(Т) – трития (на Земле всего 2 кг трития). В химии символом Н в формулах веществ обозначается содержащаяся в них природная смесь изотопов с преобладанием изотопа протий, а сами вещества рассматриваются как почти изотопночистые соединения протия.
Водород – наиболее распространенный элемент в космосе (Солнце, большие планеты Юпитер и Сатурн, звезды, межзвездная среда, туманности); в состав космической материи входит 63 % Н, 36 % Не и 1 % всех остальных элементов.
В природе – третийпо химической распространенности элемент (после О и Si), основа гидросферы. Встречается в химически связанном виде (вода, живые организмы, нефть, природный уголь, минералы), содержится в верхних слоях атмосферы.
Водород Н 2.Простое вещество. Бесцветный газ без запаха и вкуса. Молекула содержит ковалентную σ-связь Н – Н. Очень легкий, термически устойчивый до 2000 °C. Весьма мало растворим в воде. Хемосорбируется металлами Fe, Ni, Pd, Pt, где находится в атомном состоянии.
Водород Н 2может проявлять в одних условиях восстановительные свойства (чаще), в других – окислительные свойства (реже):
восстановитель Н 2 0– 2е -= 2Н I
окислитель Н 2 0 + 2е -= 2Н -I
Сильный восстановитель при высоких температурах, водород реагирует с неметаллами и оксидами малоактивных металлов, выполняет роль окислителя в реакциях с типичными металлами:
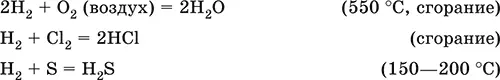

Очень высокой восстановительной способностью обладает атомарный водород Н 0(водород in statu nascendi, лат., – в момент возникновения), который получают непосредственно в зоне проводимой реакции (время жизни Н 00,5 с); например, гранулы магния вносят в подкисленный раствор переманганата калия, протекают реакции:
а) образование атомарного водорода
Mg + 2Н += Mg 2++ 2Н 0
б) восстановление перманганат-иона атомарным водородом
5Н 0+ 3H ++ MnO 4 -= Mn 2++ 4Н 2O
Другой пример – восстановление нитробензола в анилин (реакция Зинина):
а) Fe + 2Н += Fe 2++ 2Н 0
б) C 6H 5NO 2+ 6Н 0= C 6H 5NH 2+ 2Н 2O
Получить атомарный водород можно также пропусканием водорода Н 2над никелевым катализатором.
Атомарный водород легко восстанавливает при комнатной температуре весьма устойчивые соединения, например KNO 3и O 2:
2Н 0(Zn, разб. HCl) + KNO 3= KNO 2+ H 2O
2H 0(Zn, разб. HCl) + O 2= Н 2O 2
Аналогично протекают реакции при использовании амфигенов (Zn, Al) в щелочной среде:
а) Zn + 2OH -+ 2H 2O = [Zn(OH) 4] 2-+ 2Н 0
б) 8Н 0+ KNO 3= NH 3↑ + КОН + 2Н 2O (кипячение)
Качественная реакция – сгорание собранного в пробирку водорода с «хлопком» («гремучая» смесь с воздухом при содержании Н 24—74 % по объему).
Применяется водород как восстановитель и гидрирующий агент в синтезе технически важных продуктов (редкие металлы, NH 3, НCl, органические вещества).
Вода Н 2O.Бинарное соединение. Бесцветная жидкость (слой более 5 м толщиной окрашен в голубой цвет), без вкуса и запаха. Молекула имеет строение дважды незавершенного тетраэдра [:: ОН 2] (sр 3-гибридизация). Летучее вещество, термически устойчивое до 1000 °C.
В обычных условиях полярные молекулы воды образуют между собой водородные связи. Это обусловливает аномалию температур плавления и кипения воды – они значительно выше, чем у ее химических аналогов (H 2S и других). Затвердевание воды в лед сопровождается увеличением объема на 9 %, т. е. лед легче жидкой воды (вторая аномалия воды). Наибольшую плотность вода имеет не при 0 °C, а при 4 °C (третья аномалия воды). Твердая вода (лед) легко возгоняется.
Природная вода по изотопному составу водорода в основном 1Н 2O с примесью 1Н 2НО и 2Н 2O, по изотопному составу кислорода в основном Н 2 16O с примесью Н 2 18O и Н 2 17O. В малой степени подвергается диссоциации до Н +, или, точнее, до Н 3O +, и ОН; очень слабый электролит. Катион оксония Н 3O +имеет строение незавершенного тетраэдра [: O(Н) 3] (sр 3-гибридизация). Образует кристаллогидраты со многими солями, аквакомплексы – с катионами металлов. Реагирует с металлами, неметаллами, оксидами. Вызывает электролитическую диссоциацию кислот, оснований и солей, гидролизует многие бинарные соединения и соли. Подвергается электролизу в присутствии сильных электролитов. Почти универсальный жидкий растворитель неорганических веществ.
Для химических целей природную воду очищают перегонкой ( дистиллированная вода), для промышленных целей умягчают, устраняя «временную» и «постоянную» жесткость, или полностью обессоливают, пропуская через иониты в кислотной Н +-форме и щелочной ОН -– форме (ионы солей осаждаются на ионитах, а ионы Н +и ОН -переходят в воду и взаимно нейтрализуются). Питьевую воду обеззараживают хлорированием (старый способ) или озонированием (современный, но дорогой способ; озон не только окисляет вредные примеси подобно хлору, но и увеличивает содержание растворенного кислорода).
Уравнения важнейших реакций:
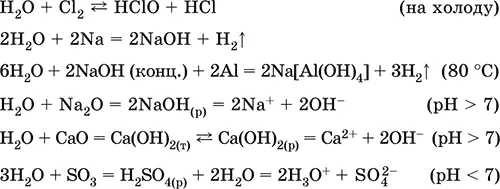
Примеры гидролиза бинарных соединений:
6H 2O + Al 2S 3= 2Al(ОН) 3↓ + 3H 2S↑
2H 2O + SF 4= SO 2↑ + 4HF↑ (40–60 °C)
6H 2O + Mg 3N 2= 3Mg(OH) 2↓ + 2NH 3↑ (кипячение)
2H 2O + CaC 2= Ca(OH) 2↓ + C 2H 2↑
Вода – окислитель за счет H I:
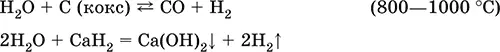
Электролиз воды:
Читать дальшеИнтервал:
Закладка:










