Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Са(ClO) 2= СаCl 2+ O 2(180 °C)
Са(ClO) 2(т)+ 4НCl (конц.) = СаCl 2+ 2Cl 2↑ + 2Н 2O (80 °C)
Са(ClO) 2+ Н 2O + СO 2= СаСO 3↓ + 2НClO (на холоду)
Са(ClO) 2+ 2Н 2O 2(разб.) = СаCl 2+ 2Н 2O + 2O 2↑
Получение:
2Са(ОН) 2(суспензия) + 2Cl 2(г)= Са(ClO) 2+ СаCl 2+ 2Н 2O
Хлорат калия КСlO 3.Соль хлорноватой кислоты НСlO 3, наиболее известная соль кислородсодержащих кислот хлора. Техническое название — бертоллетова соль (по имени ее первооткрывателя К.-Л. Бертолле, 1786). Белый, плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (образуется бесцветный раствор), гидролиза нет. Разлагается концентрированными кислотами. Сильный окислитель при сплавлении.
Применяется как компонент взрывчатых и пиротехнических смесей, головок спичек, в лаборатории – твердый источник кислорода.
Уравнения важнейших реакций:
4КClO 3= ЗКClO 4+ КCl (400 °C)
2КClO 3= 2КCl + 3O 2 (150–300 °C, кат. MnO 2)
КClO 3(т)+ 6НCl (конц.) = КCl + ЗCl 2| + ЗН 2O (50–80 °C)
ЗКClO 3(т)+ 2H 2SO 4(конц., гор.) = 2ClO 2| + КClO 4+ Н 2O + 2KHSO 4
(диоксид хлора на свету взрывается: 2ClO 2(г)= Cl 2+ 2O 2)
2КClO 3+ Е 2(изб.) = 2КЕO 3+ Cl 2↑ (в разб. HNO 3, Е = Br, I)
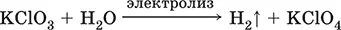
Получение КClO 3в промышленности– электролиз горячего раствора КCl (продукт КClO 3выделяется на аноде):
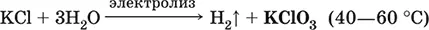
7.2.4. Бромиды. Иодиды
Бромид калия КBr.Бескислородная соль. Белый, негигроскопичный, плавится без разложения. Хорошо растворим в воде, гидролиза нет. Восстановитель (более слабый, чем KI).
Качественная реакция на ион Br – вытеснение брома из раствора КBr хлором и экстракция брома в органический растворитель, например СCl 4(в результате водный слой обесцвечивается, органический слой окрашивается в бурый цвет).
Применяется как компонент травителей при гравировке по металлам, составная часть фотоэмульсий, лекарственное средство.
Уравнения важнейших реакций:
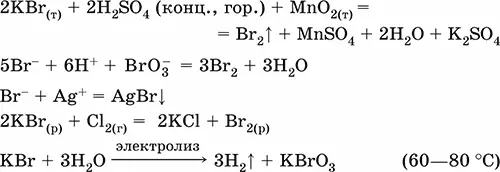
Получение:
K 2CO 3+ 2HBr = 2 KBr+ CO 2↑ + H 2O
Иодид калия KI.Бескислородная соль. Белый, негигроскопичный. При хранении на свету желтеет. Хорошо растворим в воде, гидролиза нет. Типичный восстановитель. Водный раствор KI хорошо растворяет I 2за счет комплексообразования.
Качественная реакция на ион I – вытеснение иода из раствора KI недостатком хлора и экстракция иода в органический растворитель, например СCl 4(в результате водный слой обесцвечивается, органический слой окрашивается в фиолетовый цвет).
Уравнения важнейших реакций:
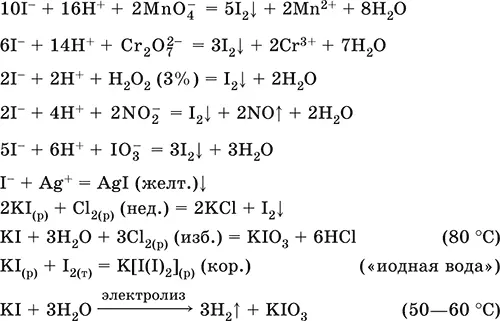
Получение:
K 2CO 3+ 2HI = 2 KI+ СO 2↑ + Н 2O
7.3. Халькогены
7.3.1. Кислород
Кислород – элемент 2-го периода и VIA-группы Периодической системы, порядковый номер 8, относится к халькогенам (но чаще рассматривается отдельно). Электронная формула атома [ 2He]2s 22p 4, характерные степени окисления чаще 0 и – II, реже – I и +II, состояние О IIсчитается устойчивым.
Шкала степеней окисления кислорода:
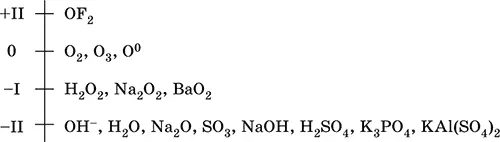
Кислород обладает высокой электроотрицательностью (3,50, второй элемент после фтора), проявляет типичные неметаллические свойства. Образует соединения со всеми элементами, кроме Не, Ne и Ar, входит в состав многочисленных оксидов, гидроксидов, солей кислородсодержащих кислот.
Природный кислород содержит изотоп 16O с примесью изотопов 17O и 18O. В химии большинство соединений природного кислорода рассматривается как изотопно-чистые соединения кислорода-16.
Кислород – самый распространенный элемент в земной коре (55 %) и природных водах, встречается в свободном и связанном виде. Жизненно важный элемент для всех организмов.
Кислород O 2.Простое вещество. Состоит из неполярных молекул О 2( дикислород ) с σπ-связью O=O, устойчивая аллотропная форма существования элемента в свободном виде. Бесцветный газ, в жидком состоянии – светло-голубой, в твердом – синий.
Составная часть воздуха: 20,94 % по объему, 23,13 % по массе. Из жидкого воздуха кислород выкипает послеазота N 2. Малорастворим в воде (31 мл/1 л Н 2O при 20 °C), но несколько лучше, чем N 2. При комнатной температуре обладает малой химической активностью из-за прочности двойной связи в молекулах.
Кислород поддерживает горение многих веществ. Сильный окислитель при высоких температурах, реагирует с большинством металлов и неметаллов:

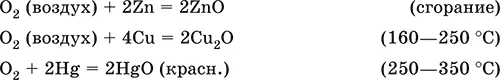
Кислород вызывает ржавление (медленное окисление) железа, уравнения реакций см. в 11.3. Особенно активен атомарный кислород О 0(активность выше, чем у озона O 3), обычно получаемый непосредственно в зоне реакции при термическом разложении многих веществ.
Простейшая качественная реакция – яркое загорание тлеющей древесной лучинки в атмосфере кислорода.
Получение кислорода:
а) в промышленности– фракционная дистилляция жидкого воздуха, электролиз воды (уравнения реакций см. в разд. 12);
б) в лаборатории– нагревание легко разлагающихся кислородсодержащих веществ:
2HgO = 2Hg + O 2 (450–500 °C)
2КMnO 4= К 2MnO 4+ MnO 2+ O 2 (200–240 °C)
2Na 2O 2= 2Na 2O + O 2 (400–675 °C, вакуум)
2КClO 3= 2КCl + 3O 2 (150–300 °C, кат. MnO 2)
2KNO 3= 2KNO 2+ O 2 (400–520 °C)
Кислород является важнейшим продуктом основного химического производства. Применяется как реагент в химической технологии (обжиг сульфидных руд, синтез оксидов), металлургии (производство чугуна и стали) и газификации природного угля, при сварке и резке металлов; жидкий кислород – окислитель топлива в ракетной технике.
Убыль кислорода в атмосфере в результате процессов горения, гниения и дыхания возмещается растениями при фотосинтезе. При вдыхании человеком и животными воздуха в легкие кислород связывается с гемоглобином крови и переносится в клетки, где органические вещества (в первую очередь глюкоза) с его помощью окисляются и обеспечивают жизненную энергию организмов.
Озон O 3.Простое вещество (трикислород), неустойчивая аллотропная форма существования элемента. Светло-синий газ с характерным («озоновым») запахом, тяжелее воздуха. Молекула имеет строение незавершенного треугольника [: O(O) 2] (sр 2-гибридизация, валентный угол 117°), содержит ковалентные σπ-связи O=O. Разлагается под действием ультрафиолетового излучения, катализаторов и оксидов азота (разрушение озонового слоя атмосферы Земли). Устойчив в смеси с O 2 (озонированный кислород). Малорастворим в воде (285 мл/1 л Н 2O), но значительно лучше, чем O 2. Сильный окислитель (более сильный, чем O 2, но более слабый, чем атомарный кислород O 0). Окисляет при комнатной температуре многие металлы и неметаллы до высоких степеней окисления. С надпероксидами щелочных металлов (К, Rb, Cs) образует оранжево-красные озониды. Не реагирует с Au, Cu, Ni, Pt, Sn. Генерируется из кислорода O 2в специальном приборе — озонаторе.
Читать дальшеИнтервал:
Закладка:










