Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Качественные реакции – осаждение сульфидов, а также неполное сгорание H 2S с образованием желтого налета серы на внесенном в пламя холодном предмете (фарфоровый шпатель). Побочный продукт очистки нефти, природного и коксового газа.
Применяется в производстве серы, неорганических и органических серосодержащих соединений как аналитический реагент. Чрезвычайно ядовит. Уравнения важнейших реакций:
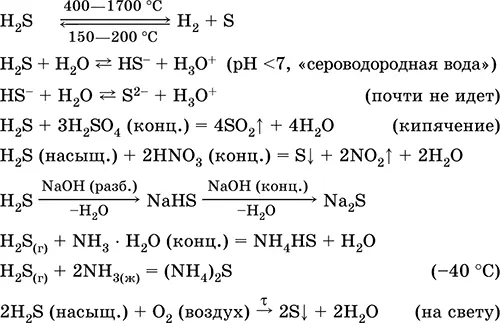

Получение : в промышленности– прямым синтезом:
Н 2+ S = H 2S (150–200 °C)
или при нагревании серы с парафином;
в лаборатории– вытеснением из сульфидов сильными кислотами
FeS + 2НCl (конц.) = FeCl 2+ H 2S↑
или полным гидролизом бинарных соединений:
Al 2S 3+ 6Н 2O = 2Al(ОН) 3↓ + 3 H 2S↑
Сульфид натрия Na 2S.Бескислородная соль. Белый, очень гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. При стоянии на воздухе раствор мутнеет (коллоидная сера) и желтеет (окраска полисульфида). Типичный восстановитель. Присоединяет серу. Вступает в реакции ионного обмена.
Качественные реакции на ион S 2-– осаждение разноокрашенных сульфидов металлов, из которых MnS, FeS, ZnS разлагаются в НCl (разб.).
Применяется в производстве сернистых красителей и целлюлозы, для удаления волосяного покрова шкур при дублении кож, как реагент в аналитической химии.
Уравнения важнейших реакций:
Na 2S + 2НCl (разб.) = 2NaCl + H 2S↑
Na 2S + 3H 2SO 4(конц.) = SO 2↑ + S↓ + 2H 2O + 2NaHSO 4 (до 50 °C)
Na 2S + 4HNO 3(конц.) = 2NO↑ + S↓ + 2H 2O + 2NaNO 3 (60 °C)
Na 2S + H 2S (насыщ.) = 2NaHS
Na 2S (т)+ 2O 2= Na 2SO 4 (выше 400 °C)
Na 2S + 4H 2O 2(конц.) = Na 2SO 4+ 4H 2O
S 2-+ M 2+= MnS (телесн.)↓; FeS (черн.)↓; ZnS (бел.)↓
S 2-+ 2Ag += Ag 2S (черн.)↓
S 2-+ M 2+= СdS (желт.)↓; PbS, CuS, HgS (черные)↓
3S 2-+ 2Bi 3+= Bi 2S 3(кор. – черн.)↓
3S 2-+ 6H 2O + 2M 3+= 3H 2S↑ + 2M(OH) 3↓ (M = Al, Cr)
Получение в промышленности– прокаливание минерала мирабилит Na 2SO 410Н 2O в присутствии восстановителей:
Na 2SO 4+ 4Н 2= Na 2S + 4Н 2O (500 °C, кат. Fe 2O 3)
Na 2SO 4+ 4С (кокс) = Na 2S + 4СО (800—1000 °C)
Na 2SO 4+ 4СО = Na 2S + 4СO 2 (600–700 °C)
Сульфид алюминия Al 2S 3.Бескислородная соль. Белый, связь Al – S преимущественно ковалентная. Плавится без разложения под избыточным давлением N 2, легко возгоняется. Окисляется на воздухе при прокаливании. Полностью гидролизуется водой, не осаждается из раствора. Разлагается сильными кислотами. Применяется как твердый источник чистого сероводорода. Уравнения важнейших реакций:
Al 2S 3+ 6Н 2O = 2Al(ОН) 3↓ + 3H 2S↑ (чистый)
Al 2S 3+ 6НCl (разб.) = 2AlCl 3+ 3H 2S↑
Al 2S 3+ 24HNO 3(конц.) = Al 2(SO 4) 3+ 24NO 2↑ + 12H 2O (100 °C)
2Al 2S 3+ 9O 2(воздух) = 2Al 2O 3+ 6SO 2 (700–800 °C)
Получение : взаимодействие алюминия с расплавленной серой в отсутствие кислорода и влаги:
2Al + 3S = AL 2S 3 (150–200 °C)
Сульфид железа (II) FeS.Бескислородная соль. Черно-серый с зеленым оттенком, тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа(II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода.
Соединение железа(III) состава Fe 2S 3не известно (не получено).
Уравнения важнейших реакций:
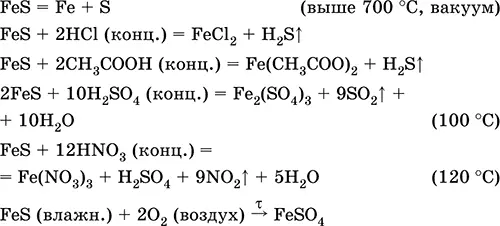
Получение:
Fe + S = FeS (600 °C)
Fe 2O 3+ H 2 + 2H 2S = 9 FeS+ 3H 2O (700-1000 °C)
FeCl 2+ 2NH 4HS (изб.) = FeS↓ + 2NH 4Cl + H 2S↑
Дисульфид железа FeS 2.Бинарное соединение. Имеет ионное строение Fe 2+(—S – S—) 2-. Темно-желтый, термически устойчивый, при прокаливании разлагается. Нерастворим в воде, не реагирует с разбавленными кислотами, щелочами. Разлагается кислотами-окислителями, подвергается обжигу на воздухе. Применяется как сырье в производстве чугуна, серы и серной кислоты, катализатор в органическом синтезе. В природе – рудные минералы пирит и марказит.
Уравнения важнейших реакций:
FeS 2= FeS + S (выше 1170 °C, вакуум)
2FeS 2+ 14H 2SO 4(конц., гор.) = Fe 2(SO 4) 3+ 15SO 2↑ + 14Н 2O
FeS 2+ 18HNO 3(конц.) = Fe(NO 3) 3+ 2H 2SO 4+ 15NO 2↑ + 7H 2O
4FeS 2+ 11O 2(воздух) = 8SO 2+ 2Fe 2O 3(800 °C, обжиг)
Гидросульфид аммония NH 4HS.Бескислородная кислая соль. Белый, плавится под избыточным давлением. Весьма летучий, термически неустойчивый. На воздухе окисляется. Хорошо растворим в воде, гидролизуется по катиону и аниону (преобладает), создает щелочную среду. Раствор желтеет на воздухе. Разлагается кислотами, в насыщенном растворе присоединяет серу. Щелочами не нейтрализуется, средняя соль (NH 4) 2S не существует в растворе (условия получения средней соли см. в рубрике «H 2S»). Применяется в качестве компонента фотопроявителей, как аналитический реагент (осадитель сульфидов).
Уравнения важнейших реакций:
NH 4HS = NH 3+ H 2S (выше 20 °C)
NH 4HS + НCl (разб.) = NH 4Cl + H 2S↑
NH 4HS + 3HNO 3(конц.) = S↓ + 2NO 2↑ + NH 4NO 3+ 2H 2O
2NH 4HS (насыщ. H 2S) + 2CuSO 4= (NH 4) 2SO 4+ H 2SO 4+ 2CuS↓
Получение : насыщение концентрированного раствора NH 3сероводородом:
NH 3Н 2O (конц.) + H 2S (г)= NH 4HS+ Н 2O
В аналитической химии раствор, содержащий равные количества NH 4HS и NH 3Н 2O, условно считают раствором (NH 4) 2S и используют формулу средней соли в записи уравнений реакций, хотя сульфид аммония полностью гидролизуется в воде до NH 4HS и NH 3 • Н 2O.
7.3.3. Диоксид серы. Сульфиты
Диоксид серы SO 2.Кислотный оксид. Бесцветный газ с резким запахом. Молекула имеет строение незавершенного треугольника [: S(O) 2] (sр 2-гибридизация), содержит σ,π-связи S=O. Легко сжижается, термически устойчивый. Хорошо растворим в воде (~40 л/1 л Н 2O при 20 °C). Образует полигидрат, обладающий свойствами слабой кислоты, продукты диссоциации – ионы HSO 3 -и SO 3 2-. Ион HSO 3 -имеет две таутомерные формы – симметричную(некислотную) со строением тетраэдра [S(H)(O) 3] (sр 3-гибридизация), которая преобладает в смеси, и несимметричную(кислотную) со строением незавершенного тетраэдра [: S(O) 2(OH)] (sр 3-гибридизация). Ион SO 3 2-также тетраэдрический [: S(O) 3].
Реагирует со щелочами, гидратом аммиака. Типичный восстановитель, слабый окислитель.
Качественная реакция – обесцвечивание желто-коричневой «йодной воды». Промежуточный продукт в производстве сульфитов и серной кислоты.
Применяется для отбеливания шерсти, шелка и соломы, консервирования и хранения фруктов, как дезинфицирующее средство, антиоксидант, хладагент. Ядовит.
Соединение состава H 2SO 3(сернистая кислота) не известно (не существует).
Читать дальшеИнтервал:
Закладка:










