Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Качественная реакция – выделение иода из раствора KI при комнатной температуре (O 2в реакцию не вступает). Уравнения важнейших реакций:

Получение : под действием электрического разряда в озонаторе:
Применяется для дезинфекции питьевой воды, при отбеливании тканей и минеральных масел, как реагент в
неорганическом и органическом синтезе. В атмосфере Земли озоновый слой (на высоте =25 км) защищает живой мир от воздействия космического ультрафиолетового излучения.
Атомарный кислород О 0.Третья аллотропная форма кислорода. Более сильный окислитель по сравнению с O 2и O 3. Образуется при распаде молекул O 2и O 3под действием ультрафиолетового излучения. Возникает при термическом разложении кислородсодержащих веществ (см. выше, получение O 2); при отсутствии восстановителей тут же переходит снова в O 2и O 3, в присутствии восстановителей окисляет их:
KNO 3= KNO 2+ O 0
О 0+ С (графит) = СO 2
Поэтому вещества, легко отщепляющие кислород при нагревании, проявляют сильные окислительные свойства.
Пероксид водорода Н 2O 2.Бинарное соединение. Молекула Н 2O 2неплоская, имеет строение с σ-связью О – О на ребре и связями Н – О на плоскостях двугранного угла. Степень окисления кислорода равна – I. Группа – О – О– называется пероксогруппой.
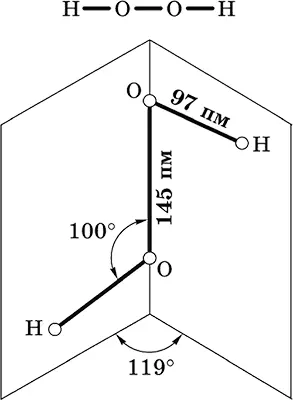
Бесцветная жидкость, вязкая, тяжелее воды, чувствительна к свету и примесям (стабилизатор Н 3РO 4). Разлагается со взрывом при слабом нагревании, на катализаторе – при комнатной температуре. Неограниченно смешивается с водой. Разбавленными щелочами нейтрализуется не полностью. Сильный окислитель, слабый восстановитель.
Пероксид водорода применяется как отбеливатель текстиля, бумаги, кож, жиров и минеральных масел, окислитель ракетного топлива, реагент в органическом синтезе, при осветлении картин старых мастеров (потемневший красочный слой из-за перехода белил – гидроксокарбонатов свинца – в черный PbS осветляют переводом в белый PbSO 4). В промышленности обычно используют взрывобезопасный 30 %-ный раствор Н 2O 2 (пергидроль), в медицине – 3 %-ный раствор.
Уравнения важнейших реакций:
2Н 2O 2= 2Н 2O + O 2 (выше 150 °C или на кат. MnO 2)
Н 2O 2(разб.) + NaOH (разб.) = NaHO 2+ Н 2O
Н 2O 2(конц.) + 2NaOH (т)= Na 2O 2↓ + 2H 2O (0 °C)
Н 2O 2(3 %) + 2H ++ 2I -= I 2↓ + 2Н 2O
5Н 2O 2(30 %) + I 2(т)= 2НIO 3+ 4Н 2O
Н 2O 2(10 %) + SO 3 2-= SO 3 2-+ H 2O
4Н 2O 2(30 %) + PbS (черн.) = 4H 2O + PbSO 4(бел.)↓
3H 2O 2+ 2[Cr(OH) 6] 3-= 2CrO 4 2-+ 8H 2O + 2OH -
2Н 2O 2(конц.) + Са(ClO) 2= СаCl 2+ 2Н 2O + 2O 2↑
5H 2O 2+ 6H ++ 2MnO 4 -= 2Mn 2++ 5O 2↑ + 8Н 2O
Получение : в лабораториивначале синтезируют пероксид бария ВаO 2:
2ВаО + O 2(изб.) = 2ВаO 2 (до 500 °C),
а затем его обрабатывают серной кислотой:
ВаO 2+ H 2SO 4= BaSO 4↓ + Н 2O 2 (на холоду)
В промышленности(старый метод) – электролиз водного раствора H 2SO 4или (NH 4) 2SO 4в специальных условиях; при этом кислота или соль не расходуются, а протекает электролиз воды с образованием на аноде Н 2O 2:
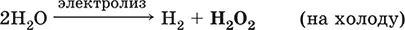
Современный промышленный способ (8O% мирового производства) – окисление сложного органического соединения 2-этилантрагидрохинон кислородом воздуха на холоду.
7.3.2. Сера. Сероводород. Сульфиды
Сера – элемент 3-го периода и VIA-группы Периодической системы, порядковый номер 16, относится к халькогенам. Электронная формула атома [ 10Ne]3s 23p 4, характерные степени окисления 0, -II, +IV и +VI, состояние S VIсчитается устойчивым.
Шкала степеней окисления серы:
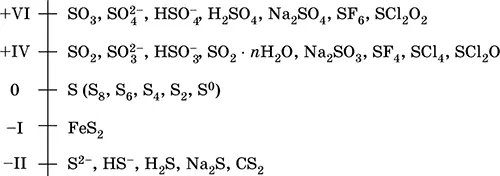
Электроотрицательность серы равна 2,60, для нее характерны неметаллические свойства. В водородных и кислородных соединениях находится в составе различных анионов, образует кислородсодержащие кислоты и их соли, бинарные соединения.
В природе – пятнадцатыйпо химической распространенности элемент (седьмой среди неметаллов). Встречается в свободном (самородном) и связанном виде. Жизненно важный элемент для высших организмов.
Сера S.Простое вещество. Желтая кристаллическая (α-ромбическая и β-моноклинная,  при 95,5 °C) или аморфная (пластическая). В узлах кристаллической решетки находятся молекулы S 8(неплоские циклы типа «корона»), аморфная сера состоит из цепей S n. Низкоплавкое вещество, вязкость жидкости проходит через максимум при 200 °C (разрыв молекул S 8, переплетение цепей S n). В паре – молекулы S 8, S 6, S 4, S 2. При 1500 °C появляется одноатомная сера (в химических уравнениях для простоты любая сера изображается как S).
при 95,5 °C) или аморфная (пластическая). В узлах кристаллической решетки находятся молекулы S 8(неплоские циклы типа «корона»), аморфная сера состоит из цепей S n. Низкоплавкое вещество, вязкость жидкости проходит через максимум при 200 °C (разрыв молекул S 8, переплетение цепей S n). В паре – молекулы S 8, S 6, S 4, S 2. При 1500 °C появляется одноатомная сера (в химических уравнениях для простоты любая сера изображается как S).
Сера не растворяется в воде и при обычных условиях не реагирует с ней, хорошо растворима в сероуглероде CS 2.
Сера, особенно порошкообразная, обладает высокой активностью при нагревании. Реагирует как окислитель с металлами и неметаллами:
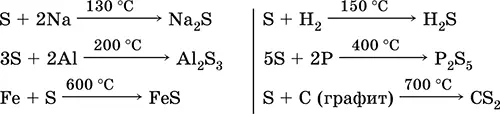
а как восстановитель– с фтором, кислородом и кислотами (при кипячении):
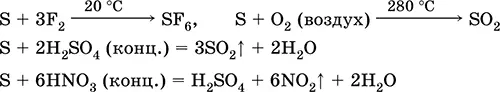
Сера подвергается дисмутации в растворах щелочей:
3S 0+ 6КОН (конц.) = 2K 2S -II+ K 2S IVO 3+ 3H 2O
При высокой температуре (400 °C) сера вытесняет иод из иодоводорода:
S + 2НI (г)= I 2+ H 2S,
но в растворе реакция идет в обратную сторону:
I 2+ H 2S (p)= 2 HI + S↓
Получение : в промышленностивыплавляется из природных залежей самородной серы (с помощью водяного пара), выделяется при десульфурации продуктов газификации угля.
Сера применяется для синтеза сероуглерода, серной кислоты, сернистых (кубовых) красителей, при вулканизации каучука, как средство защиты растений от мучнистой росы, для лечения кожных заболеваний.
Сероводород H 2S.Бескислородная кислота. Бесцветный газ с удушающим запахом, тяжелее воздуха. Молекула имеет строение дважды незавершенного тетраэдра [::S(H) 2]
(sp 3-гибридизация, валетный угол Н – S—Н далек от тетраэдрического). Неустойчив при нагревании выше 400 °C. Малорастворим в воде (2,6 л/1 л Н 2O при 20 °C), насыщенный раствор децимолярный (0,1М, «сероводородная вода»). Очень слабая кислота в растворе, практически не диссоциирует по второй стадии до ионов S 2-(максимальная концентрация S 2-равна 1 10 -13моль/л). При стоянии на воздухе раствор мутнеет (ингибитор – сахароза). Нейтрализуется щелочами, не полностью – гидратом аммиака. Сильный восстановитель. Вступает в реакции ионного обмена. Сульфидирующий агент, осаждает из раствора разноокрашенные сульфиды с очень малой растворимостью.
Читать дальшеИнтервал:
Закладка:










