Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Уравнения важнейших реакций: 100–128 °C
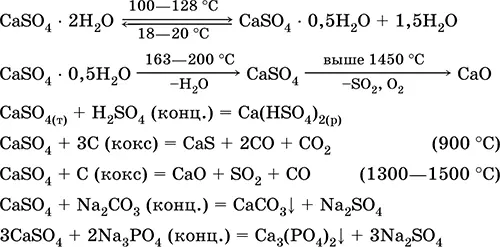
Применяется как сырье в производстве SO 2, H 2SO 4и (NH 4) 2SO 4, как флюс в металлургии, наполнитель бумаги. Приготовленный из жженого гипса вяжущий строительный раствор «схватывается» быстрее, чем смесь на основе Са(ОН) 2. Затвердевание обеспечивается связыванием воды, образованием гипса в виде каменной массы. Используется жженый гипс для изготовления гипсовых слепков, архитектурно-декоративных форм и изделий, перегородочных плит и панелей, каменных полов.
Сульфат алюминия-калия KAl(SO 4) 2.Двойная оксосоль. Белый, гигроскопичный. При сильном нагревании разлагается. Образует кристаллогидрат — алюжокалиевые квасцы. Умеренно растворим в воде, гидролизуется по катиону алюминия. Реагирует со щелочами, гидратом аммиака.
Применяется как протрава при крашении тканей, дубитель кож, коагулянт при очистке пресной воды, компонент составов для проклеивания бумаги, наружное кровоостанавливающее средство в медицине и косметологии. Образуется при совместной кристаллизации сульфатов алюминия и калия.
Уравнения важнейших реакций:
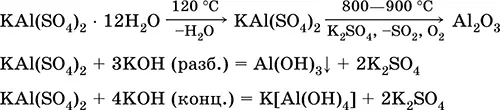
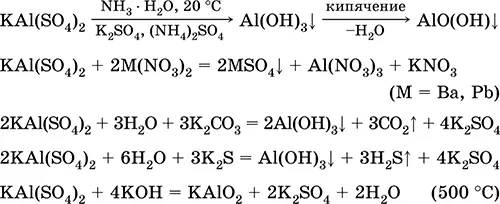
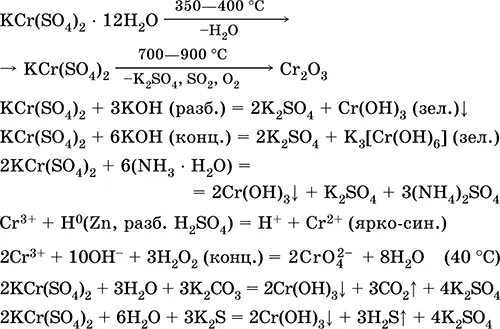
Сульфат хрома(III) – калия KCr(SO 4) 2.Двойная оксосоль. Красный (гидрат темно-фиолетовый, техническое название хрожокалиевые квасцы). При нагревании разлагается без плавления. Хорошо растворим в воде (серо-синяя окраска раствора отвечает аквакомплексу [Cr(Н 2O) 6] 3+), гидролизуется по катиону хрома(III). Реагирует со щелочами, гидратом аммиака. Слабый окислитель и восстановитель. Вступает в реакции ионного обмена.
Качественные реакции на ион Cr 3+– восстановление до Cr 2+или окисление до желтого CrO 4 2-.
Применяется как дубитель кож, протрава при крашении тканей, реактив в фотографии. Образуется при совместной кристаллизации сульфатов хрома(III) и калия. Уравнения важнейших реакций:

Сульфат марганца (II) MnSO 4.Оксосоль. Белый, при прокаливании плавится и разлагается. Кристаллогидрат MnSO 45Н 2O – красно-розовый, техническое название марганцевый купорос. Хорошо растворим в воде, светло-розовая (почти бесцветная) окраска раствора отвечает аквакомплексу [Mn(Н 2O) 6] 2+; гидролизуется по катиону. Реагирует со щелочами, гидратом аммиака. Слабый восстановитель, реагирует с типичными (сильными) окислителями.
Качественные реакции на ион Mn 2+– конмутация с ионом MnO 4и исчезновение фиолетовой окраски последнего, окисление Mn 2+до MnO 4и появление фиолетовой окраски.
Применяется для получения Mn, MnO 2и других соединений марганца, как микроудобрение и аналитический реагент.
Уравнения важнейших реакций:
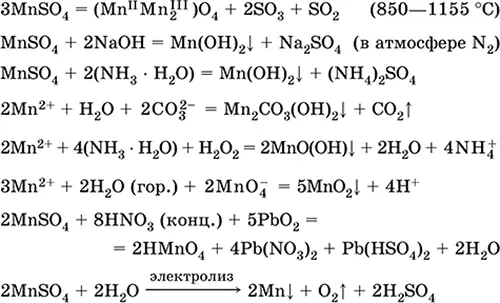
Получение:
2MnO 2+ 2H 2SO 4(конц.) = 2 MnSO 4+ O 2↑ + 2H 2O (100 °C)
Сульфат железа (II) FeSO 4.Оксосоль. Белый (гидрат светло-зеленый, техническое название железный купорос), гигроскопичный. Разлагается при нагревании. Хорошо растворим в воде, в малой степени гидролизуется по катиону. Быстро окисляется в растворе кислородом воздуха (раствор желтеет и мутнеет). Реагирует с кислотами-окислителями, щелочами, гидратом аммиака. Типичный восстановитель.
Применяется как компонент минеральных красок, электролитов в гальванотехнике, консервант древесины, фунгицид, лекарственное средство против анемии. В лаборатории чаще берется в виде двойной соли Fe(NH 4) 2(SO 4) 26Н 2O ( соль Мора), более устойчивой к действию воздуха.
Уравнения важнейших реакций:
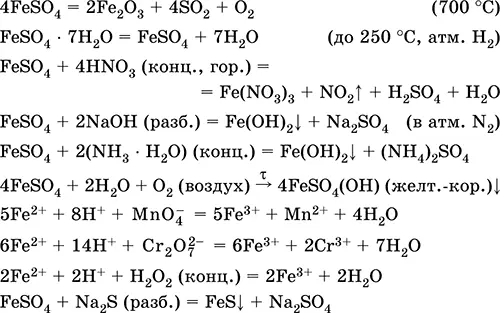
Получение:
Fe + H 2SO 4(разб.) = FeSO 4+ H 2↑
FeCO 3+ H 2SO 4(разб.) = FeSO 4+ CO 2↑ + H 2O
7.4. Неметаллы VA-группы
7.4.1. Азот. Аммиак
Азот – элемент 2-го периода и VA-группы Периодической системы, порядковый номер 7. Электронная формула атома [ 2He]2s 22p 3, характерные степени окисления 0, -III, +III и +V, реже +II, +IV и др.; состояние N vсчитается относительно устойчивым.
Шкала степеней окисления азота:

Азот обладает высокой электроотрицательностью (3,07), третий после F и О. Проявляет типичные неметаллические (кислотные) свойства. Образует различные кислородсодержащие кислоты, соли и бинарные соединения, а также катион аммония NH 4 +и его соли.
В природе – семнадцатыйпо химической распространенности элемент (девятый среди неметаллов). Жизненно важный элемент для всех организмов.
Азот N 2.Простое вещество. Состоит из неполярных молекул с очень устойчивой σππ-связью N ≡ N, этим объясняется химическая инертность азота при обычных условиях. Бесцветный газ без вкуса и запаха, конденсируется в бесцветную жидкость (в отличие от O 2).
Главная составная часть воздуха: 78,09 % по объему, 75,52 % по массе. Из жидкого воздуха азот выкипает раньше кислорода O 2. Малорастворим в воде (15,4 мл/1 л Н 2O при 20 °C), растворимость азота меньше, чем у кислорода.
При комнатной температуре N 2реагирует только с литием (во влажной атмосфере), образуя нитрид лития Li 3N, нитриды других элементов синтезируют при сильном нагревании:
N 2+ 3Mg = Mg 3N 2(800 °C)
В электрическом разряде N 2реагирует с фтором и в очень малой степени – с кислородом:

Обратимая реакция получения аммиака протекает при 500 °C, под давлением до 350 атм и обязательно в присутствии катализатора (Fe/F 2O 3/FeO, в лаборатории Pt):
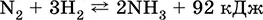
В соответствии с принципом Ле-Шателье увеличение выхода аммиака должно происходить при повышении давления и понижении температуры. Однако скорость реакции при низких температурах очень мала, поэтому процесс ведут при 450–500 °C, достигая 15 %-ного выхода аммиака. Непрореагировавшие N 2и Н 2возвращают в реактор и тем самым увеличивают степень протекания реакции.
Азот химически пассивен по отношению к кислотам и щелочам, не поддерживает горения.
Читать дальшеИнтервал:
Закладка:










