Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Получение в промышленности– фракционная дистилляция жидкого воздуха или удаление из воздуха кислорода химическим путем, например по реакции 2С (кокс) + O 2= 2СО при нагревании. В этих случаях получают азот, содержащий также примеси благородных газов (главным образом аргон).
В лабораториинебольшие количества химически чистого азота можно получить по реакции конмутации при умеренном нагревании:
N -IIIH 4N IIIO 2(т)= N 2 0+ 2H 2O (60–70 °C)
NH 4Cl (p)+ KNO 2(p)= N 2 0↑ + KCl + 2H 2O (100 °C)
Применяется для синтеза аммиака, азотной кислоты и других азотсодержащих продуктов, как инертная среда проведения химических и металлургических процессов и хранения огнеопасных веществ.
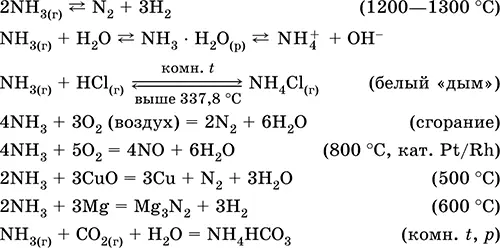
Аммиак NH 3.Бинарное соединение, степень окисления азота равна – III. Бесцветный газ с резким характерным запахом. Молекула имеет строение незавершенного тетраэдра [: N(H) 3)] (sр 3-гибридизация). Наличие у азота в молекуле NH 3донорной пары электронов на sр 3-гибридной орбитали обусловливает характерную реакцию присоединения катиона водорода, при этом образуется катион аммония NH 4 +. Сжижается под избыточным давлением при комнатной температуре. В жидком состоянии ассоциирован за счет водородных связей. Термически неустойчив. Хорошо растворим в воде (более 700 л/1 л Н 2O при 20 °C); доля в насыщенном растворе равна = 34 % по массе и = 99 % по объему, рН = 11,8.
Весьма реакционноспособный, склонен к реакциям присоединения. Crорает в кислороде, реагирует с кислотами. Проявляет восстановительные (за счет N -III) и окислительные (за счет Н I) свойства. Осушается только оксидом кальция.
Качественные реакции – образование белого «дыма» при контакте с газообразным НCl, почернение бумажки, смоченной раствором Hg 2(NO 3) 2.
Промежуточный продукт при синтезе HNO 3и солей аммония. Применяется в производстве соды, азотных удобрений, красителей, взрывчатых веществ; жидкий аммиак – хладагент. Ядовит.
Уравнения важнейших реакций:
Получение : в лаборатории– вытеснение аммиака из солей аммония при нагревании с натронной известью (NaOH + СаО):
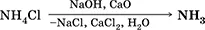
или кипячение водного раствора аммиака с последующим осушением газа.
В промышленностиаммиак синтезируют из азота (см.) с водородом. Выпускается промышленностью либо в сжиженном виде, либо в виде концентрированного водного раствора под техническим названием аммиачная вода.
Гидрат аммиака NH 3Н 2O.Межмолекулярное соединение. Белый, в кристаллической решетке – молекулы NH 3и Н 2O, связанные слабой водородной связью H 3N… НОН. Присутствует в водном растворе аммиака, слабое основание (продукты диссоциации – катион NH 4 -и анион ОН -). Катион аммония имеет правильно-тетраэдрическое строение (sp 3-гибридизация). Термически неустойчив, полностью разлагается при кипячении раствора. Нейтрализуется сильными кислотами. Проявляет восстановительные свойства (за счет N III) в концентрированном растворе. Вступает в реакции ионного обмена и комплексообразования.
Качественная реакция – образование белого «дыма» при контакте с газообразным НCl.
Применяется для создания слабощелочной среды в растворе, при осаждении амфотерных гидроксидов.
В 1М растворе аммиака содержится в основном гидрат NH 3Н 2O и лишь 0,4 % ионов NH 4 +и ОН -(за счет диссоциации гидрата); таким образом, ионный «гидроксид аммония NH 4OH» практически не содержится в растворе, нет такого соединения и в твердом гидрате. Уравнения важнейших реакций:
NH 3Н 2O (конц.) = NH 3↑ + Н 2O (кипячение с NaOH)
NH 3Н 2O + НCl (разб.) = NH 4Cl + Н 2O
3(NH 3Н 2O) (конц.) + CrCl 3= Cr(OH) 3↓ + 3NH 4Cl
8(NH 3Н 2O) (конц.) + ЗBr 2(р)= N 2↑ + 6NH 4Br + 8Н 2O (40–50 °C)
2(NH 3Н 2O) (конц.) + 2КMnO 4= N 2↑ + 2MnO 2↓ + 4Н 2O + 2КОН
4(NH 3Н 2O) (конц.) + Ag 2O = 2[Ag(NH 3) 2]OH + 3H 2O
4(NH 3Н 2O) (конц.) + Cu(OH) 2+ [Cu(NH 3) 4](OH) 2+ 4Н 2O
6(NH 3Н 2O) (конц.) + NiCl 2= [Ni(NH 3) 6]Cl 2+ 6Н 2O
Разбавленный раствор аммиака (3—10 %-ный) часто называют нашатырным спиртом (название придумано алхимиками), а концентрированный раствор (18,5—25 %-ный) – аммиачной водой (выпускается промышленностью).
7.4.2. Оксиды азота. Азотная кислота
Монооксид азота NO.Несолеобразующий оксид. Бесцветный газ. Радикал, содержит ковалентную σπ-связь ( N=O), в твердом состоянии димер N 2O 2со связью N – N. Чрезвычайно термически устойчив. Чувствителен к кислороду воздуха (буреет). Мало растворим в воде и не реагирует с ней. Химически пассивен по отношению к кислотам и щелочам. При нагревании реагирует с металлами и неметаллами. Весьма реакционноспособна смесь NO и NO 2(«нитрозные газы»). Промежуточный продукт в синтезе азотной кислоты.
Уравнения важнейших реакций:
2NO + O 2(изб.) = 2NO 2(20 °C)
2NO + С (графит) = N 2+ СO 2(400–500 °C)
lONO + 4Р (красн.) = 5N 2+ 2Р 2O 5(150–200 °C)
2NO + 4Cu = N 2+ 2Cu 2O (500–600 °C)
Реакции смеси NO и NO 2:
NO + NO 2+ Н 2O = 2HNO 2(p)
NO + NO 2+ 2KOH (разб.) = 2KNO 2+ H 2O
NO + NO 2+ Na 2CO 3= 2NaNO 2+ CO 2(450–500 °C)
Получение : в промышленности– окисление аммиака (см.) кислородом на катализаторе, в лаборатории– взаимодействие разбавленной азотной кислоты с восстановителями:
8HNO 3(хол.) + 6Hg = 3Hg 2(NO 3) 2+ 2 NO↑ + 4Н 2O
или восстановление нитритов:
2NaNO 2+ 2H 2SO 4(разб.) + 2NaI = 2 NO↑ + I 2↓ + 2H 2O + 2Na 2SO 4
Диоксид азота NO 2.Кислотный оксид, условно отвечает двум кислотам – HNO 2и HNO 3(кислота для N IVне существует). Бурый газ, при комнатной температуре мономер NO 2, на холоду жидкий бесцветный димер N 2O 4(тетраоксид диазота). Молекула NO 2– радикал со строением незавершенного треугольника [-N(O) 2] (sр 2-гибридизация) с ковалентными σ, π-связями N=O. Молекула N 2O 4содержит очень длинную связь N – N (175 пм), которая легко разрывается при температуре выше комнатной (в интервале 20,7—135,0 °C). Полностью реагирует с водой, щелочами. Очень сильный окислитель, вызывает коррозию металлов. Усиливает химическую активность NO (см.). Применяется для синтеза азотной кислоты и безводных нитратов, как окислитель ракетного топлива, очиститель нефти от серы и катализатор окисления органических соединений. Ядовит. Уравнения важнейших реакций:
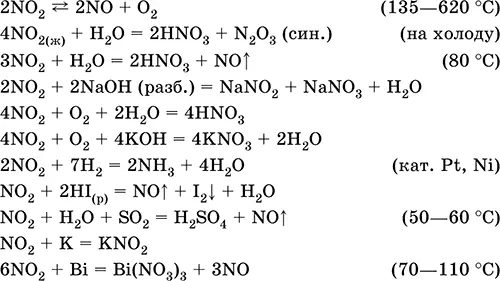
Получение : в промышленности– окисление NO (см.) кислородом воздуха, в лаборатории– взаимодействие концентрированной азотной кислоты с восстановителями:
6HNO 3(конц., гор.) + S = H 2SO 4+ 6NO 2↑ + 2Н 2O
5HNO 3(конц., гор.) + Р (красн.) = Н 3РO 4+ 5NO 2↑ + Н 2O
2HNO 3(конц., гор.) + SO 2= H 2SO 4+ 2NO 2↑
Оксид диазота N 2O.Бесцветный газ с приятным запахом («веселящий газ»), N=N=O, формальная степень окисления азота +I, плохо растворим в воде. Поддерживает горение графита и магния:
Читать дальшеИнтервал:
Закладка:










