Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Уравнения важнейших реакций:
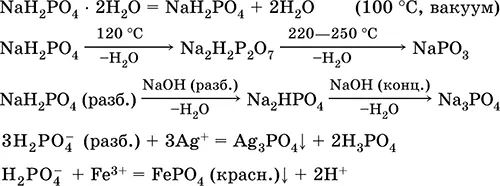
Получение: неполная нейтрализация Н 3РO 4едким натром:
Н 3РO 4(конц.) + NaOH (разб.) = NaH 2PO 4+ Н 2O
Ортофосфат кальция Са 3(РO 4) 2. Оксосоль. Белый, тугоплавкий, термически устойчивый. Нерастворим в воде. Разлагается концентрированными кислотами. Восстанавливается коксом при сплавлении. Основной компонент фосфоритных руд (апатиты и др.).
Применяется для получения фосфора, в производстве фосфорных удобрений (суперфосфаты), керамики и стекла, осажденный порошок – как компонент зубных паст и стабилизатор полимеров.
Уравнения важнейших реакций:
Са 3(РO 4) 2+ 2H 2SO 4(60 %) = Са(Н 2РO 4) 2↓ + 2CaSO 4↓ (до 50 °C)
Са 3(РO 4) 2+ 4Н 3РO 4(40 %) = ЗСа(Н 2РO 4) 2↓ (примесь СаНРO 4)
Са 3(РO 4) 2+ 5С + 3SiO 2= 3CaSiO 3+ 2Р + 5СО (1000 °C)
Смесь Са(Н 2РO 4) 2и CaSO 4называется простым суперфосфатом, Са(Н 2РO 4) 2с примесью СаНРO 4— двойным суперфосфатом, они легко усваиваются растениями при подкормке.
Наиболее ценные удобрения — аммофосы (содержат азот и фосфор), представляют собой смесь аммонийных кислых солей NH 4H 2PO 4и (NH 4) 2HPO 4.
Хлорид фосфора (V) РCl 5.Бинарное соединение. Белый, летучий, термически неустойчивый. Молекула имеет строение тригональной бипирамиды (sр 3d-гибридизация). В твердом состоянии димер Р 2Cl 10с ионным строением РCl 4 +[РCl 6] -. «Дымит» во влажном воздухе. Весьма реакционноспособный, полностью гидролизуется водой, реагирует со щелочами. Восстанавливается белым фосфором. Применяется как хлорагент в органическом синтезе. Ядовит.
Уравнения важнейших реакций:
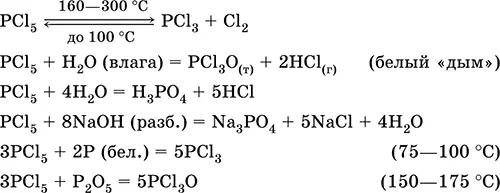
Получение: хлорирование фосфора.
7.5. Неметаллы IVA-группы
7.5.1. Углерод в свободном виде
Углерод – элемент 2-го периода и IVA-группы Периодической системы, порядковый номер 6. Химия углерода – это в основном химия органических соединений; неорганических производных углерода не так много. Электронная формула атома [ 3He]2s 22p 2, характерные степени окисления 0, -IV, +II и +IV, состояние C IVсчитается устойчивым.
Шкала степеней окисления углерода:

Углерод имеет среднюю для неметаллов электроотрицательность (2,50), проявляет неметаллические (кислотные) свойства. Неорганические углеродсодержащие вещества – оксиды, угольная кислота и ее соли, бинарные соединения; органические вещества – практически неограниченное число соединений с водородом (углеводороды) и их производных, содержащих различные по длине цепи и циклы атомов углерода.
В природе – одиннадцатыйпо химической распространенности элемент (четвертый среди неметаллов). Встречается в самородном состоянии (алмаз, графит) и в виде соединений. Жизненно важный элемент для всех организмов.
Аллотропные формы углерода С.В свободном виде углерод существует в виде четырех аллотропных модификаций: графит, алмаз, карбин и фуллерен.
Г р а ф и т – устойчивая аллотропная форма существования элемента. Серо-черный, с металлическим блеском, жирный на ощупь, мягкий, обладает электропроводимостью. Кристаллическая решетка состоит из слоев правильных шестиугольных колец, конденсированных по всем сторонам за счет оя-связей (вр 2-гибридизация). Реагирует с водяным паром, кислотами-окислителями. Типичный восстановитель при сплавлении, реагирует с кислородом, оксидами металлов и солями. Восстанавливается водородом и металлами.
Для графита характерно образование множества карбидов – солеобразных (СаС 2, Al 4С 3), ковалентных (карборунд SiC), металлоподобных (имеющих нестехиометрический состав, например цементит Fe 3C). Солеобразные карбиды полностью гидролизуются в воде.
Применяется как конструкционный материал, основа угольных электродов, замедлитель нейтронов в ядерных реакторах, кокс – восстановитель в металлургии и химической технологии, сажа – наполнитель резины.
Алмаз содержит в узлах кристаллической решетки атомы С с тетраэдрическим окружением (sр 3-гибридизация, р 3,52 г/см 3). Благородный камень, имеет наибольшую твердость среди природных веществ. Химическая активность ниже, чем у графита. Выше 1200 °C переходит в графит. В чистом состоянии алмазы – прозрачные бесцветные кристаллы с сильным преломляющим эффектом. После обработки природных алмазов (огранка, шлифовка) получают ювелирные драгоценные камни — бриллианты. Менее чистые алмазы обычно окрашенные и мутные, например серо-голубой и черный (карбонадо).
В промышленности из графита при 2000 °C под очень высоким давлением получают мелкие кристаллы искусственных алмазов. Применяются они для изготовления режущих инструментов и точных измерительных приборов.
Карбинсостоит из линейных макромолекул (С 2) nсо строением —C≡C– или =C=C= (sр-гибридизация, ρ 3,27 г/см 3). Химически менее активен, чем графит. При 2300 °C переходит в графит. Прозрачен и бесцветен, полупроводник. Широкого применения не имеет, очень редко встречается в природе.
Фуллеренсостоит из молекул C 60или C 70(полые сферы; sр 2-гибридизация, ρ 1,7 г/см 3, температура плавления 500–600 °C для С 60), термически устойчив до 900– 1000 °C.
Темноокрашенный порошок, растворим в гексане (темно-красный раствор для С 60темно-оранжевый для С 70), полупроводник. Химические свойства изучены мало. Получают фуллерен, испаряя графит в атмосфере гелия при пониженном давлении. Обнаружен в природе. Возможное использование в будущем – основа сверхпроводящих материалов.
Ниже рассматриваются свойства графитакак самой распространенной и химически активной формы углерода.
Уравнения важнейших реакций:

Получение: искусственные формы графита — кокс и сажа образуются при пиролизе каменного угля и углеводородов.
7.5.2. Оксиды углерода
Монооксид углерода СО.Несолеобразующий оксид. Бесцветный газ, без запаха, легче воздуха. Молекула слабополярна, содержит ковалентную тройную σππ-связь [:C≡O;], изоэлектронна молекуле N 2. Термически устойчив. Малорастворим в воде и не реагирует с ней. Химически пассивен в обычных условиях, не реагирует с кислотами и щелочами. Сильный восстановитель при высокой температуре и при наличии катализаторов. Вступает в реакции присоединения с кислородом и пероксидом натрия. С переходными металлами образует комплексные соединения без внешней сферы ( карбонилы ). Количественно реагирует с I 2O 5.
Читать дальшеИнтервал:
Закладка:










