Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Na 2SiO 3+ SiO 2= СO 2+ Na 2SiO 3(1150 °C)
Силикаты. Кремний в степени окисления +IV находится, помимо SiO 2, в весьма многочисленных и часто очень сложных по составу и строению силикат-ионах (так, кроме жетасиликат-иона SiO 3 2-и ортосиликат-иона SiO 4 4-известны ионы Si 2O 7 6-, Si 3O 9 6-, Si 2O 10 4- и др.). Для простоты записи все силикаты изображают как содержащие ион SiO 3 2-.
Насыщенный раствор силикатов натрия и калия (вязкое «жидкое стекло») используется как силикатный клей.
Силикаты натрия и кальция входят в состав стекла; его получают сплавлением кварца SiO 2, известняка СаСO 3и соды Na 2CO 3:
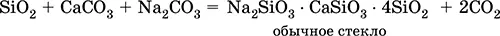
Часто состав стекла выражают через оксиды, например, обычное стекло Na 2O СаО • 6SiO 2.
Среди силикатных минералов отметим глины (алюмосиликаты ), очень чистая глина — каолин Al 2O 32SiO 2 • 2Н 2O используется для изготовления фарфора.
Силикаты и алюмосиликаты применяют в промышленности при производстве керамики, цемента, бетона и других строительных материалов.
Тетрахлорид кремния SiCl 4.Бинарное соединение. Бесцветная жидкость, обладает широким интервалом жидкого состояния. Молекула имеет тетраэдрическое строение (sр 3-гибридизация). Термически устойчив. «Дымит» во влажном воздухе. Полностью гидролизуется водой. Разлагается щелочами. Восстанавливается водородом, натрием, цинком. Хлорирует оксид алюминия.
Применяется в производстве особо чистого кремния для полупроводниковой техники.
Уравнения важнейших реакций:
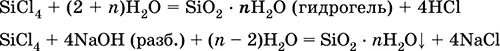
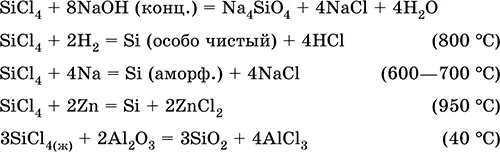
Получение в промышленности– хлорирование кремния или кварцевого песка SiO 2.
1. Хлор можно собрать
1) в пробирку отверстием вниз
2) в пробирку отверстием вверх
3) над раствором хлорида кальция
4) над водой
2. Пропускают хлор через горячий раствор едкого кали и получают набор продуктов
1) КCl, O 2
2) КCl, КClO
3) КCl, Н 2
4) КClO 3, КCl
3. Возможно протекание реакции в растворе между веществами
1) КBr + I 2 →…
2) КBr + Cl 2→…
3) КCl + I 2→…
4) КCl + Br 2→…
4. Окислительная способность в ряду O 2– O 3– О 0
1) возрастает
2) убывает
3) не изменяется
4) не знаю
5. При действии концентрированным раствором щелочи на серу образуется набор солей
1) сульфат, сульфид
2) сульфат, сульфит
3) сероводород, серная кислота
4) сульфит, сульфид
6. Концентрированная серная кислота реагирует (по отдельности) с веществами набора
1) KHSO 4, K 2SO 4
2) Fe, Cu(NO 3) 2
3) Ag, SO 2
4) КНСO 3, С (графит)
7. Азот образуется при прокаливании солей
1) NH 4NO 2
2) NH 4HCO 3
3) NH 4NO 3
4) (NH 4) 2Cr 2O 7
8. В уравнении реакции NH 3+ O 2→ NO +… коэффициент у формулы окислителя равен
1) 6
2) 5
3) 4
4) 3
9. Нельзяпроводить осушку газа NH 3с помощью
1) СаО (тв.)
2) NaOH (тв.)
3) H 2SO 4(конц.)
4) Р 2O 5(тв.)
10. Две соли разных кислот образуются при взаимодействии между щелочью и
1) диоксидом углерода
2) триоксидом серы
3) оксидом хлора (VII)
4) оксидом азота (IV)
11. Один газ образуется при прокаливании
1) Cu(NO 3) 2
2) Pb(NO 3) 2
3) AgNO 3
4) KNO 3
12. Ортофосфорную кислоту в промышленности получают по реакции
1) Са 3(РO 4) 2+ H 2SO 4(конц.) →…
2) К 3РO 4+ H 2SO 4(разб.) →…
3) Р 2O 5+ Н 2O →…
4) Na 3PO 4+ СаCl 2→…
13. Углекислый газ, растворенный в воде, реагирует (по отдельности) с веществами набора
1) К 2СO 3, К 3РO 4
2) KNO 2, NH 4Cl
3) K 2SiO 3, К 2СO 3
4) K 2SO 4, КОН
14. Реагенты для получения чистого гидрокарбоната калия – это набор
1) KNO 3, Н 2O, СO 2
2) K 2SO 4, Ва(НСO 3) 2
3) К 2СO 3, Н 2O
4) КОН, СаСO 3
15. Цинк из концентрированного раствора карбоната калия вытесняет
1) водород
2) угарный газ
3) метан
4) углекислый газ
16. Влажную смесь газов SO 2+ O 2+ NH 3+ С 2Н 2пропустили через склянку с H 2SO 4(конц.), затем – через склянку с гранулами NaOH. При этом на выходе собрали набор газов
1) NH 3, С 2Н 2
2) SO 2, O 2
3) SO 2, NH 3
4) O 2, С 2Н 2
17. Для обнаружения хлорид-иона подходит реактив
1) раствор крахмала
2) раствора нитрата серебра(I)
3) разбавленная серная кислота
4) концентрированный раствор щелочи
18. Для распознавания Na 2CO 3и Na 2SiO 3можно использовать раствор
1) азотной кислоты
2) индикатора
3) хлорида бария
4) гидроксида натрия
19—22. Бесцветный раствор соли
19. иодид алюминия
20. гидросульфат калия
21. хлорид бария
22. фторид натрия окрасится метилоранжем в цвет
1) оранжевый
2) желтый
3) синий
4) розовый
8. Теория строения, многообразие, классификация и номенклатура органических соединений. Типы химических реакций
Многообразие органических соединений, их свойств и превращений объясняет теория химического строения (А. М. Бутлеров, 1861–1864).
Химическое строение – это определенная последовательность расположения атомов в молекуле. Строение молекулы органического соединения изображается структурной формулой (развернутой или сокращенной), в которой символы связанных атомов соединяются валентной чертой, например, для этанола С 2Н 5ОН:
развернутая структурная формула
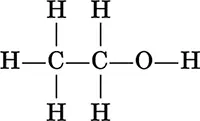
сокращенная структурная формула
СН 3—СН 2—ОН
Часто одинарные связи вообще не указывают: СН 3СН 2ОН
По строению различают ациклические и циклические органические соединения.
Ациклические соединения характеризуются открытой цепью атомов углерода:
а) насыщенные соединения (с одинарными связями С – С)
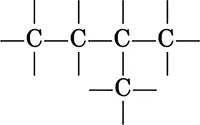
б) ненасыщенные соединения (с кратными связями C=C и C≡C)
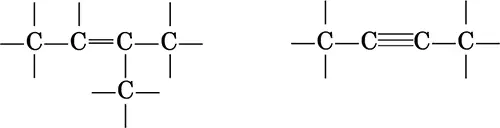
Ациклические соединения могут содержать как прямуюцепь атомов углерода, так и разветвленную. Различают атомы углерода:
первичный, соединен с одним другим атомом углерода;
вторичный, соединен с двумя атомами углерода;
третичный, соединен с тремя атомами углерода;
четвертичный, соединен с четырьмя атомами углерода.
Прямая углеродная цепь состоит только из первичных и вторичных атомов углерода, разветвленная цепь содержит также третичные и четвертичные атомы.
Пример:
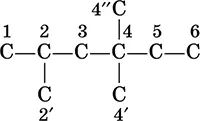
1, 2', 4', 4", 6 – первичные атомы
Читать дальшеИнтервал:
Закладка:










