Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
1) нейтрализации
2) присоединения
3) полимеризации
4) изомеризации
23—25. Взаимодействие между реагентами
23. С 6Н 6, HNO 3
24. C 2H 4, НCl
25. C 2H 2, КMnO 4
по отношению к углеводороду называется
1) окислением
2) присоединением
3) восстановлением
4) замещением
26. Установите соответствие между формулой функциональной группы и классом органических соединений, который она определяет.

27. Установите соответствие между названием соединения и классом, к которому оно относится

9. Углеводороды. Гомология и изомерия. Химические свойства и способы получения
9.1. Алканы. Циклоалканы
Алканы( парафины ) – это соединения углерода с водородом, в молекулах которых атомы углерода соединены между собой одинарной связью ( предельные углеводороды). Общая формула гомологического ряда алканов С nН 2n+2. Радикал, получающийся при отрыве одного атома водорода от молекулы предельного углеводорода, называется алкилож, общая формула алкилов С nН 2n+1.
Формулы и названия первых шести алканов (С 1—С 6) и отвечающих им радикалов:
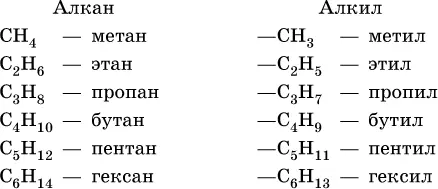
Для радикала С 5Н 11использование названия амил не рекомендуется. Для составления названийалканов с разветвленной цепью, например
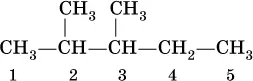
выбирают самую длинную углеродную цепь (в примере – 5 атомов) и получают основу названия (5 – пентан). Нумеруют цепь (от 1 до 5) так, чтобы заместители (—СН 3) получили наименьшие номера (2 и 3). В названии арабскими цифрами указывают положение заместителей, а приставками ди– 2, три– 3, тетра– 4 и т. д. – число одинаковых заместителей. Таким образом, в нашем примере алкан должен быть назван 2,3-диметилпентан.
При наличии разных заместителей их названия расставляют по алфавиту, т. е., например, сначала метил, а затем этил.
Для некоторых разветвленных предельных углеводородов используются, наравне с систематическими, традиционныеназвания, например, для алканов состава С 4Н 10и С 5Н 12с формулами:
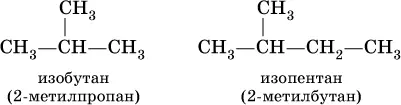
Такие же названия используются для разветвленных радикалов:
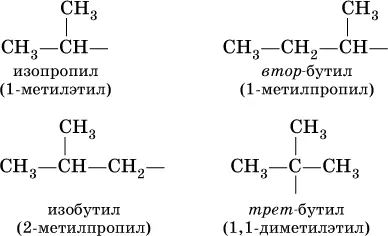
При обычных условиях первые алканы – метан, этан, пропан и бутан (С 1—С 4) – представляют собой газы без цвета и запаха, малорастворимые в воде. Последующие гомологи (С 5—C 15) – жидкости (при 20 °C), высшие гомологи (C 16и выше) – твердые вещества.
В алканах атомные орбитали углерода имеют sр 3-гибридизацию; четыре электронных облака атома углерода направлены в вершины тетраэдра под углами 109,5°. Ковалентные связи, образуемые каждым атомом углерода, в алканах малополярны.
Поэтому алканы – сравнительно инертные вещества, вступают только в реакции замещения, протекающие с симметричным (радикальным) разрывом связей С – Н. Эти реакции обычно идут в жестких условиях (высокая температура, освещение). В результате становится возможным замещение водорода на галоген (CI, Br) и нитрогруппу (NO 2), например, при обработке метана хлором:
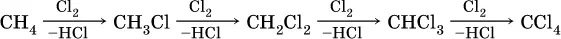
Вторая и последующие стадии реакции протекают легче, чем первая, из-за смещения электронной плотности к атому хлора:
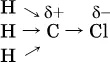
и увеличения подвижности остающихся атомов водорода. Названия продуктов: СН 3Cl – хлорметан, СН 2Cl 2– дихлорметан, СНCl 3– трихлорметан ( хлороформ ), СCl 4– тетрахлорметан (тетрахлорид углерода).
В тех алканах, где кроме первичных есть также вторичные и третичные атомы углерода, замещение обычно протекает с образованием смеси однозамещенных продуктов (т. е. в каждой молекуле замещается один атом водорода), например:
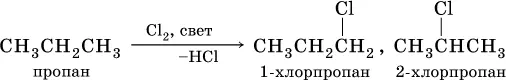
Циклоалканы– предельные углеводороды циклического строения, общая формула гомологического ряда С nH 2n(п  3), формула совпадает с таковой для алкенов. Важнейшие циклоалканы:
3), формула совпадает с таковой для алкенов. Важнейшие циклоалканы:
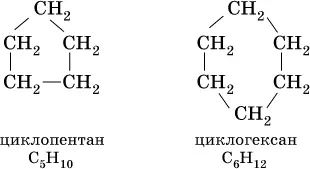
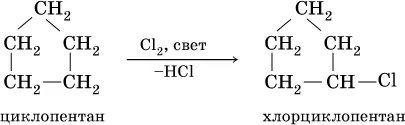
При комнатной температуре С 5Н 10и С 6Н 12– бесцветные жидкости, малорастворимые в воде. Химические свойства циклоалканов подобны свойствам алканов, например:
Получение : источниками алканов и циклоалканов в промышленностислужат нефть, природный газ, каменный уголь. В лабораторииприменяют такие способы синтеза алканов:
1) реакция Вюрца – действие натрия на галогенпроизводные углеводородов:
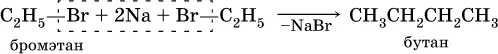
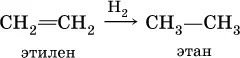
2) каталитическое гидрирование этиленовых углеводородов (катализаторы Pt, Pd, Ni):
3) сплавление солей карбоновых кислот с гидроксидом натрия:
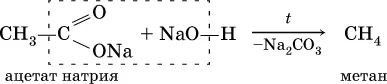
Циклоалканы синтезируют из дигалогенпроизводных алканов:
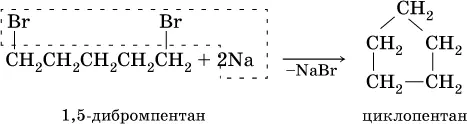
Алканы широко используются как исходное сырье в химической промышленности, моторное топливо (бензин, керосин и др.); циклоалканы применяются в органическом синтезе.
При горении метана выделяется много теплоты:
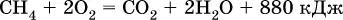
Поэтому его (в виде природного газа) применяют в качестве топлива в быту и в промышленности.
Читать дальшеИнтервал:
Закладка:










