Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
2N 2O + С = СO 2+ 2N 2 (450 °C)
N 2O + Mg = N 2+ MgO (500 °C)
Получают термическим разложением нитрата аммония:
NH 4NO 3= N 2O + 2Н 2O (195–245 °C)
Применяется в медицине как анестезирующее средство.
Триоксид диазота N 2O 3.При низких температурах – синяя жидкость, ON=NO 2, формальная степень окисления азота +III. При 20 °C на 90 % разлагается на смесь бесцветного NO и бурого NO 2(«нитрозные газы», промышленный дым – «лисий хвост»). N 2O 3– кислотный оксид, на холоду с водой образует HNO 2, при нагревании реагирует иначе:
3N 2O 3+ Н 2O = 2HNO 3+ 4NO↑
Со щелочами дает соли HNO 2, например NaNO 2.
Получают взаимодействием NO с O 2(4NO + 3O 2= 2N 2O 3) или с NO 2(NO + NO 2= N 2O 3) при сильном охлаждении. «Нитрозные газы» ядовиты и экологически опасны, действуют как катализаторы разрушения озонового слоя атмосферы.
Пентаоксид диазота N 2O 5.Бесцветное твердое вещество, O 2N – О—NO 2, степень окисления азота +V. При комнатной температуре за 10 ч разлагается на NO 2и O 2. Реагирует с водой и щелочами как кислотный оксид:
N 2O 5+ Н 2O = 2HNO 3
N 2O 5+ 2NaOH = 2NaNO 3+ H 2O
Получают дегидратацией дымящей азотной кислоты:
2HNO 3+ Р 2O 5= N 2O 5+ 2НРO 3
или окислением NO 2озоном при -78 °C:
2NO 2+ O 3= N 2O 5+ O 2
Азотная кислота HNO 3.Оксокислота. Бесцветная жидкость. Молекула имеет искаженно-треугольное строение [N(O) 2(OH)] (sp 2– гибридизация), содержит ковалентные σπ-связи N=O и о-связь N – ОН. Разлагается при стоянии на свету (желтеет). Хорошо растворяет оксиды азота (красно-бурая «дымящая» кислота, плотность 1,56 г/мл). Неограниченно смешивается с водой, перегоняется при обычных условиях в виде азеотропной смеси (массовая доля кислоты 68,4 %, плотность 1,41 г/мл, температура кипения 120,7 °C), образует гидрат HNO 3Н 2O (точнее, H 3NO 4– ортоазотная кислота).
Сильная кислота в растворе, ион NO 3 -имеет строение правильного треугольника (sр 2-гибридизация). Нейтрализуется щелочами и гидратом аммиака. Реагирует с основными и амфотерными оксидами и гидроксидами, вытесняет слабые кислоты из их солей. Сильный окислитель в концентрированном растворе (за счет N v). Образует смесь продуктов восстановления азота – от N IVO 2до N -IIIН 4 +, в зависимости от концентрации кислоты и силы восстановителя в этой смеси преобладают разные продукты (условно для концентрированной кислоты указывают NO 2, для разбавленной – NO, для очень разбавленной – NH 4 +).
Концентрированная кислота пассивирует Al, Be, Bi, Со, Cr, Fe, Ni и Pb, не реагирует с Au и Pt. Смесь HNO 3(конц.) и НCl (конц.) – « царская водка » – обладает еще более сильным окислительным действием: переводит в раствор золото и платину. Нитрующим началом HNO 3в ее реакциях с органическими веществами является ион NO 2 +( нитроил).
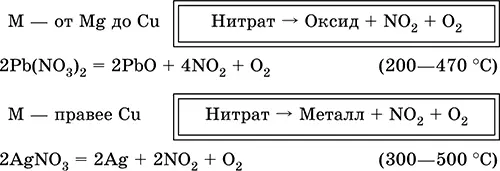
В отличие от самой кислоты HNO 3ее соли — нитраты проявляют сильные окислительные свойства только при сплавлении за счет выделяющегося кислорода. При нагревании нитраты разлагаются по-разному, в зависимости от положения металла в ряду напряжений:

Применяется азотная кислота для производства минеральных удобрений, взрывчатых веществ, нитратов металлов, органических нитропроизводных, искусственных волокон и пластмасс, красителей, лекарственных препаратов.
Уравнения важнейших реакций:

Получение : промышленныйсинтез состоит из следующих этапов:
N 2+ Н 2→ NH 3→ NO → NO 2→ HNO 3→ HNO 3,
а именно: производство аммиака (см.), каталитическое окисление аммиака (см.) до NO, перевод NO (см.) в NO 2, поглощение смеси NO 2и O 2водой (см.).
7.4.3. Нитриты. Нитраты
Нитрит калия KNO 2. Оксосоль. Белый, гигроскопичный. Плавится без разложения. Устойчив в сухом воздухе. Очень хорошо растворим в воде (образуется бесцветный раствор), гидролизуется по аниону. Типичный окислитель и восстановитель в кислотной среде, очень медленно реагирует в щелочной среде. Вступает в реакции ионного обмена. Качественные реакции на ион NO 2 -– обесцвечивание фиолетового раствора MnO 4и появление черного осадка при добавлении ионов I -. Применяется в производстве красителей, как аналитический реагент на аминокислоты и иодиды, компонент фотографических реактивов.
Уравнения важнейших реакций:
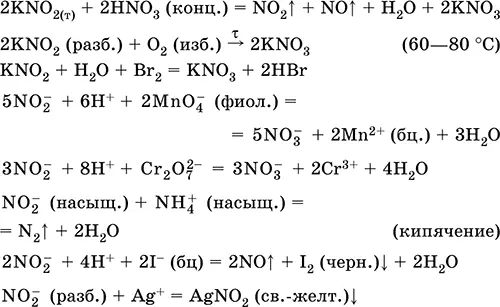
Получение в промышленности– восстановлением калийной селитры в процессах:
KNO 3+ Pb = KNO 2+ PbO (350–400 °C)
KNO 3(конц.) + Pb (губка) + Н 2O = KNO 2+ Pb(OH) 2↓
2KNO 3+ СаО + SO 2= 2 KNO 2+ CaSO 4 (300 °C)
Нитрат калия KNO 3.Оксосоль. Техническое название калийная, или индийская, селитра. Белый, плавится без разложения, при дальнейшем нагревании разлагается. Устойчив на воздухе. Хорошо растворим в воде (с высоким эндо -эффектом, Q = -36 кДж), гидролиза нет. Сильный окислитель при сплавлении (за счет выделения атомарного кислорода). В растворе восстанавливается только атомарным водородом (в кислотной среде до KNO 2, в щелочной среде до NH 3).
Применяется в производстве стекла, как консервант пищевых продуктов, компонент пиротехнических смесей и минеральных удобрений.
Уравнения важнейших реакций:

Получение : в промышленности
4KOH (гор.) + 4NO 2+ O 2= 4 KNO 3+ 2Н 2O
и в лаборатории:
КCl + AgNO 3= KNO 3+ AgCl↓
7.4.4. Фосфор
Фосфор – элемент 3-го периода и VA-группы Периодической системы, порядковый номер 15. Электронная формула атома [ 10Ne]3s 23p 3, устойчивая степень окисления в соединениях +V.
Шкала степеней окисления фосфора:
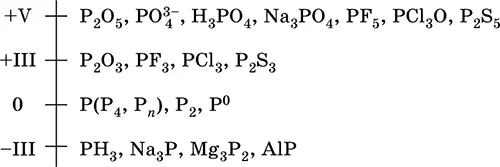
Электроотрицательность фосфора (2,32) значительно ниже, чем у типичных неметаллов, и немного выше, чем у водорода. Образует различные кислородсодержащие кислоты, соли и бинарные соединения, проявляет неметаллические (кислотные) свойства. Большинство фосфатов нерастворимы в воде.
В природе – тринадцатыйпо химической распространенности элемент (шестой среди неметаллов), встречается только в химически связанном виде. Жизненно важный элемент.
Недостаток фосфора в почве восполняется введением фосфорных удобрений – главным образом суперфосфатов.
Красный и белый фосфор Р.Известно несколько аллотропных форм фосфора в свободном виде, главные – это белый фосфор Р 4и красный фосфор Р n. В уравнениях реакций аллотропные формы представляют как Р (красн.) и Р (бел.).
Читать дальшеИнтервал:
Закладка:










