Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Уравнения важнейших реакций:
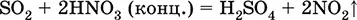
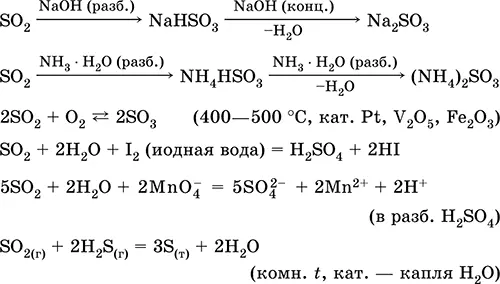
Растворение в воде и кислотные свойства:
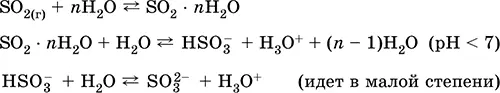
Получение : в промышленности – сжигание серы в воздухе, обогащенном кислородом, и, в меньшей степени, обжиг сульфидных руд (SO 2– попутный газ при обжиге пирита):
S + O 2= SO 2 (280–360 °C)
4FeS 2+ 11O 2= 2Fe 2O 3+ 8 SO 2 (800 °C, обжиг)
в лаборатории – вытеснение серной кислотой из сульфитов:
BaSO 3(т)+ H 2SO 4(конц.) = BaSO 4↓ + SO 2↑ + Н 2O
Сульфит натрия Na 2SO 3.Оксосоль. Белый. При нагревании на воздухе разлагается без плавления, плавится под избыточным давлением аргона. Во влажном состоянии и в растворе чувствителен к кислороду воздуха. Хорошо растворим в воде, гидролизуется по аниону. Разлагается кислотами. Типичный восстановитель.
Качественная реакция на ион SO 3 2-– образование белого осадка сульфита бария, который переводится в раствор сильными кислотами (НCl, HNO 3).
Применяется как реактив в аналитической химии, компонент фотографических растворов, нейтрализатор хлора при отбеливании тканей.
Уравнения важнейших реакций:
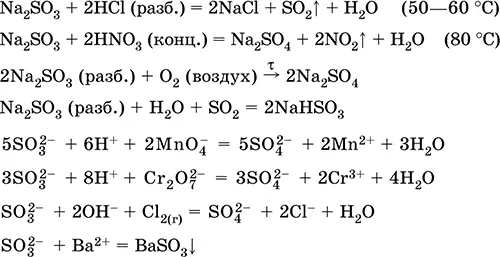
Получение:
Na 2CO 3(конц.) + SO 2= Na 2SO 3+ CO 2↑
7.3.4. Серная кислота. Сульфаты
Серная кислота H 2SO 4.Оксокислота. Бесцветная жидкость, очень вязкая (маслообразная), весьма гигроскопичная. Молекула имеет искаженно-тетраэдрическое строение [S(O) 2(OH) 2] (sр 3-гибридизация), содержит ковалентные σ-связи S – ОН и σπ-связи S=O. Ион SO 4 2-имеет правильно-тетраэдрическое строение [S(O) 4]. Обладает широким температурным интервалом жидкого состояния (~300 градусов). При нагревании выше 296 °C частично разлагается. Перегоняется в виде азеотропной смеси с водой (массовая доля кислоты 98,3 %, температура кипения 296–340 °C), при более сильном нагревании разлагается полностью. Неограниченно смешивается с водой (с сильным экзо -эффектом). Сильная кислота в растворе, нейтрализуется щелочами и гидратом аммиака. Переводит металлы в сульфаты (при избытке концентрированной кислоты в обычных условиях образуются растворимые гидросульфаты), но металлы Be, Bi, Со, Fe, Mg и Nb пассивируются в концентрированной кислоте и не реагируют с ней. Реагирует с основными оксидами и гидроксидами, разлагает соли слабых кислот. Слабый окислитель в разбавленном растворе (за счет Н I), сильный – в концентрированном растворе (за счет S VI). Хорошо растворяет SO 3и реагирует с ним (образуется тяжелая маслообразная жидкость — олеум, содержит H 2S 2O 7).
Качественная реакция на ион SO 4 2-– осаждение белого сульфата бария BaSO 4(осадок не переводится в раствор соляной и азотной кислотами, в отличие от белого осадка BaSO 3).
Применяется в производстве сульфатов и других соединений серы, минеральных удобрений, взрывчатых веществ, красителей и лекарственных препаратов, в органическом синтезе, для «вскрытия» (первого этапа переработки) промышленно важных руд и минералов, при очистке нефтепродуктов, электролизе воды, как электролит свинцовых аккумуляторов. Ядовита, вызывает ожоги кожи. Уравнения важнейших реакций:
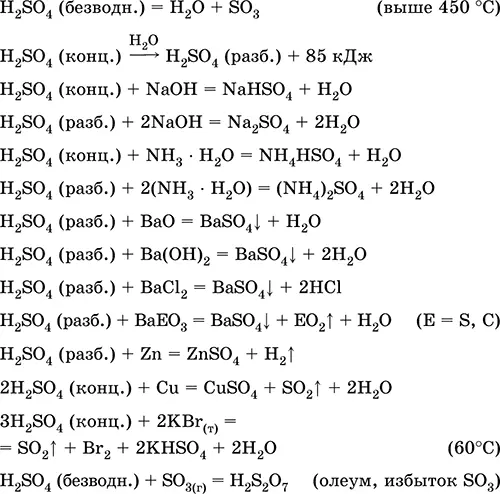
Получение в промышленности:
а) синтез SO 2из серы, сульфидных руд, сероводорода и сульфатных руд:
S + O 2(воздух) = SO 2 (280–360 °C)
4FeS 2+ 11O 2(воздух) = 8 SO 2+ 2Fe 2O 3 (800 °C, обжиг)
2H 2S + 3O 2(изб.) = 2 SO 2+ 2Н 2O (250–300 °C)
CaSO 4+ С (кокс) = СаО + SO 2+ СО (1300–1500 °C)
б) конверсия SO 2в SO 3в контактном аппарате:
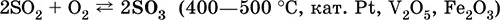
в) синтез концентрированной и безводной серной кислоты:
Н 2O (разб. H 2SO 4) + SO 3= H 2SO 4(конц., безводн.)
(поглощение SO 3чистой водой с получением H 2SO 4не проводится из-за сильного разогревания смеси и обратного разложения H 2SO 4, см. выше);
г) синтез олеума – смеси безводной H 2SO 4, дисерной кислоты H 2S 2O 7и избыточного SO 3. Растворенный SO 3гарантирует безводность олеума (при попадании воды тут же образуется H 2SO 4), что позволяет безопасно перевозить его в стальных цистернах.
Сульфат натрия Na 2SO 4.Оксосоль. Белый, гигроскопичный. Плавится и кипит без разложения. Образует кристаллогидрат (минерал мирабилит), легко теряющий воду; техническое название глауберова соль. Хорошо растворим в воде, не гидролизуется. Реагирует с H 2SO 4(конц.), SO 3. Восстанавливается водородом, коксом при нагревании. Вступает в реакции ионного обмена.
Применяется в производстве стекла, целлюлозы и минеральных красок, как лекарственное средство. Содержится в рапе соляных озер, в частности в заливе Кара-Богаз-Гол Каспийского моря.
Уравнения важнейших реакций:
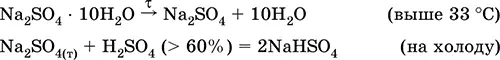
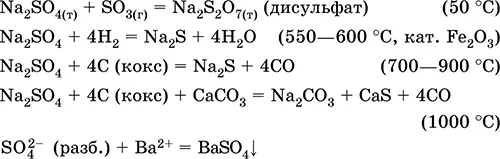
Гидросульфат калия KHSO 4.Кислая оксосоль. Белый, гигроскопичный, но кристаллогидратов не образует. При нагревании плавится и разлагается. Хорошо растворим в воде, в растворе анион подвергается диссоциации, среда раствора сильнокислотная. Нейтрализуется щелочами.
Применяется как компонент флюсов в металлургии, составная часть минеральных удобрений.
Уравнения важнейших реакций:
2KHSO 4= K 2SO 4+ H 2SO 4 (до 240 °C)
2KHSO 4= K 2S 2O 7+ Н 2O (320–340 °C)
KHSO 4(разб.) + КОН (конц.) = K 2SO 4+ Н 2O KHSO 4+ КCl = K 2SO 4+ НCl (450–700 °C)
6KHSO 4+ М 2O 3= 2KM(SO 4) 2+ 2K 2SO 4+ 3H 2O (350–500 °C, M = Al, Cr)
Получение : обработка сульфата калия концентрированной (более чем 6O%-ной) серной кислотой на холоду:
K 2SO 4+ H 2SO 4(конц.) = 2 KHSO 4
Сульфат кальция CaSO 4.Оксосоль. Белый, весьма гигроскопичный, тугоплавкий, при прокаливании разлагается. Природный CaSO 4встречается в виде очень распространенного минерала гипс CaSO 42Н 2O. При 130 °C гипс теряет часть воды и переходит в жжёный (штукатурный) гипс 2CaSO 4 • Н 2O (техническое название алебастр). Полностью обезвоженный (200 °C) гипс отвечает минералу ангидрит CaSO 4. Малорастворим в воде (0,206 г/100 г Н 2O при 20 °C), растворимость уменьшается при нагревании. Реагирует с H 2SO 4(конц.). Восстанавливается коксом при сплавлении. Определяет большую часть «постоянной» жесткости пресной воды (подробнее см. 9.2).
Читать дальшеИнтервал:
Закладка:










