Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ
- Название:Химия. Полный справочник для подготовки к ЕГЭ
- Автор:
- Жанр:
- Издательство:Array Array
- Год:2009
- Город:Москва
- ISBN:978-5-17-060638-2, 978-5-271-24368-4
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Ростислав Лидин - Химия. Полный справочник для подготовки к ЕГЭ краткое содержание
Теоретический материал изложен в краткой, доступной форме. Каждый раздел сопровождается примерами тестовых заданий, позволяющими проверить свои знания и степень подготовленности к аттестационному экзамену. Практические задания соответствуют формату ЕГЭ. В конце пособия приводятся ответы к тестам, которые помогут школьникам и абитуриентам проверить себя и восполнить имеющиеся пробелы.
Пособие адресовано старшим школьникам, абитуриентам и учителям.
Химия. Полный справочник для подготовки к ЕГЭ - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
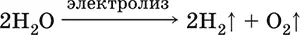
Электропроводность чистой (дистиллированной) воды весьма мала, поэтому электролиз проводят в присутствии сильных электролитов.
а) в нейтральномрастворе (электролит Na 2SO 4)
катод 2H 2O + 2е -= H 2↑ + 2OH
анод 2Н 2O – 4е -= O 2↑ + 4H +
раствор ОН -+ Н += Н 2O
б) в кисломрастворе (электролит H 2SO 4)
катод 2Н ++ 2е - = Н 2↑
анод 2Н 2O – 4е -= O 2↑ + 4Н +
в) в щелочномрастворе (электролит NaOH)
катод 2Н 2O + 2е -= Н 2↑ + 2OН -
анод 4OН -– 4е -= O 2↑ + 2Н 2O
Один из методов обнаружения воды основан на переходе во влажной атмосфере белого сульфата меди(II) CuSO 4в голубой медный купорос CuSO 45Н 2O.
Известна изотопная разновидность воды — тяжелая вода D 2O ( 2Н 2O); в природных водах массовое отношение D 2O: Н 2O = 1: 6000.
Плотность, температуры плавления и кипения тяжелой воды выше, чем у обыкновенной. Растворимость большинства веществ в тяжелой воде значительно меньше, чем в обычной воде. Она ядовита, так как замедляет биологические процессы в живых организмах. Тяжелая вода накапливается в остатке электролита при многоразовом электролизе воды. Используется как теплоноситель и замедлитель нейтронов в ядерных реакторах.
Гидрид кальция СаН 2.Бинарное соединение. Белый, имеет ионное строение Са 2+(Н -) 2. При плавлении разлагается. Чувствителен к кислороду воздуха. Сильный восстановитель, реагирует с водой, кислотами. Применяется как твердый источник водорода (1 кг СаН 2дает 1000 л Н 2), осушитель газов и жидкостей, аналитический реагент для количественного определения воды в кристаллогидратах.
Уравнения важнейших реакций:
СаН 2= Н 2+ Са (особо чистый) (выше 1000 °C)
СаН 2+ 2Н 2O = Са(ОН) 2+ 2Н 2↑
СаН 2+ 2НCl (разб.) = СаCl 2+ 2Н 2↑
СаН 2+ O 2= Н 2O + СаО (особо чистый) (300–400 °C)
ЗСаН 2+ N 2= ЗН 2+ Ca 3N 2 (выше 1000 °C)
ЗСаН 2+ 2КClO 3= 2КCl + ЗСаО + ЗН 2O (450–550 °C)
СаН 2+ H 2S = CaS + 2Н 2 (500–600 °C)
Получение : обработка нагретого кальция водородом.
7.2. Галогены
7.2.1. Хлор. Хлороводород
Хлор – элемент 3-го периода и VII А-группы Периодической системы, порядковый номер 17. Электронная формула атома [ 10Ne]3s 23p 5, характерные степени окисления 0, -I, +I, +V и +VII. Наиболее устойчиво состояние Cl -I. Шкала степеней окисления хлора:

Хлор обладает высокой электроотрицательностью (2,83), проявляет неметаллические свойства. Входит в состав многих веществ – оксидов, кислот, солей, бинарных соединений.
В природе – двенадцатыйпо химической распространенности элемент (пятый среди неметаллов). Встречается только в химически связанном виде. Третий по содержанию элемент в природных водах (после О и H), особенно много хлора в морской воде (до 2 % по массе). Жизненно важный элемент для всех организмов.
Хлор Cl 2.Простое вещество. Желто-зеленый газ с резким удушливым запахом. Молекула Cl 2неполярна, содержит σ-связь CI–Cl. Термически устойчив, негорюч на воздухе; смесь с водородом взрывается на свету (водород сгорает в хлоре):
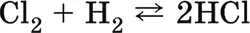
Хорошо растворим в воде, подвергается в ней дисмутации на 50 % и полностью – в щелочном растворе:
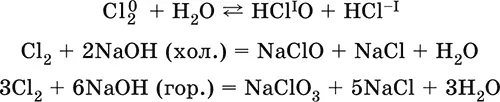
Раствор хлора в воде называют хлорной водой, на свету кислота НClO разлагается на НCl и атомарный кислород О 0, поэтому «хлорную воду» надо хранить в темной склянке. Наличием в «хлорной воде» кислоты НСlO и образованием атомарного кислорода объясняются ее сильные окислительные свойства: например, во влажном хлоре обесцвечиваются многие красители.
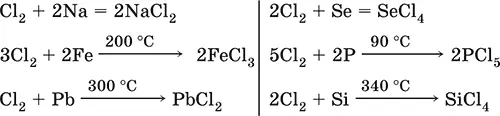
Хлор очень сильный окислитель по отношению к металлам и неметаллам:
Реакции с соединениями других галогенов:
а) Cl 2+ 2KBr (p)= 2КCl + Br 2↑ (кипячение)
б) Cl 2(нед.) + 2KI (p)= 2КCl + I 2↓
3Cl 2(изб.) + ЗН 2O + KI = 6НCl + КIO 3 (80 °C)
Качественная реакция – взаимодействие недостатка Cl 2с KI (см. выше) и обнаружение иода по синему окрашиванию после добавления раствора крахмала.
Получение хлора в промышленности:
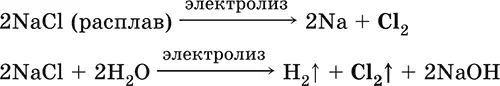
и в лаборатории:
4НCl (конц.) + MnO 2= Cl 2↑ + MnCl 2+ 2Н 2O
(аналогично с участием других окислителей; подробнее см. реакции для НCl и NaCl).
Хлор относится к продуктам основного химического производства, используется для получения брома и иода, хлоридов и кислородсодержащих производных, для отбеливания бумаги, как дезинфицирующее средство для питьевой воды. Ядовит.
Хлороводород НCl.Бескислородная кислота. Бесцветный газ с резким запахом, тяжелее воздуха. Молекула содержит ковалентную σ-связь Н – Cl. Термически устойчив. Очень хорошо растворим в воде; разбавленные растворы называются хлороводородной кислотой, а дымящий концентрированный раствор (35–38 %) – соляной кислотой (название дано еще алхимиками). Сильная кислота в растворе, нейтрализуется щелочами и гидратом аммиака. Сильный восстановитель в концентрированном растворе (за счет Cl -I), слабый окислитель в разбавленном растворе (за счет Н I). Составная часть «царской водки».
Качественная реакция на ион Cl -– образование белых осадков AgCl и Hg 2Cl 2, которые не переводятся в раствор действием разбавленной азотной кислоты.
Хлороводород служит сырьем в производстве хлоридов, хлорорганических продуктов, используется (в виде раствора) при травлении металлов, разложении минералов и руд.
Уравнения важнейших реакций:
НCl (разб.) + NaOH (разб.) = NaCl + Н 2O
HCl (разб.) + NH 3H 2O = NH 4Cl + Н 2O
4HCl (конц., гор.) + МО 2= МCl 2+ Cl 2↑ + 2H 2O (М = Mn, Pb)
16HCl (конц., гор.) + 2КMnO 4(т)= 2MnCl 2+ 5Cl 2↑ + 8H 2O + 2КCl
14HCl (конц.) + К 2Cr 2O 7(т)= 2CrCl 3+ ЗCl 2↑ + 7H 2O + 2КCl
6HCl (конц.) + КClO 3(т)= КCl + ЗCl 2↑ + 3H 2O (50–80 °C)
4HCl (конц.) + Са(ClO) 2(т)= СаCl 2+ 2Cl 2| + 2Н 2O
2HCl (разб.) + М = МCl 2+ H 2↑ (М = Fe, Zn)
2HCl (разб.) + МСO 3= МCl 2+ СO 2↑ + H 2O (М = Са, Ва)
HCl (разб.) + AgNO 3= HNO 3+ AgCl↓
Получение НCl в промышленности – сжигание Н 2в Cl 2(см.), в лаборатории – вытеснение из хлоридов серной кислотой:
NaCl (т)+ H 2SO 4(конц.) = NaHSO 4+ НCl↑ (50 °C)
2NaCl (т)+ H 2SO 4(конц.) = Na 2SO 4+ 2НCl↑ (120 °C)
7.2.2. Хлориды
Хлорид натрия NaCl.Бескислородная соль. Бытовое название поваренная соль. Белый, слабогигроскопичный. Плавится и кипит без разложения. Умеренно растворим в воде, растворимость мало зависит от температуры, раствор имеет характерный соленый вкус. Гидролизу не подвергается. Слабый восстановитель. Вступает в реакции ионного обмена. Подвергается электролизу в расплаве и растворе.
Читать дальшеИнтервал:
Закладка:










