М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Энтропия S – физическая величина, характеризующая степень беспорядка системы. S – стандартная энтропия, ΔS – изменение стандартной энтропии. Если ΔS > 0, беспорядок растет, если AS < 0, то беспорядок системы уменьшается. Для процессов в которых растет число частиц, ΔS > 0. Для процессов, в которых число частиц уменьшается, ΔS < 0. Например, энтропия меняется в ходе реакций:
СаО(тв) + Н 2O(ж) = Са(OH) 2(тв), ΔS < 0;
CaCO 3(тв) = СаО(тв) + CO 2(г), ΔS > 0.
Самопроизвольно идут процессы с выделением энергии, т. е. для которых Δ Н < 0, и с увеличением энтропии, т. е. для которых ΔS > 0. Учет обоих факторов приводит к выражению для энергии Гиббса: G = Н – TS или Δ G = ΔН – Т • ΔS. Реакции, в которых энергия Гиббса уменьшается, т. е. ΔG < 0, могут идти самопроизвольно. Реакции, в ходе которых энергия Гиббса увеличивается, т. е. ΔG > 0, самопроизвольно не идут. Условие ΔG = 0 значит, что между продуктами и реагентами установилось равновесие.
При низкой температуре, когда величина Т близка к нулю, идут лишь экзотермические реакции, так как TΔS – мало и ΔG = Δ Н < 0. При высоких температурах значения TΔS велико, и, пренебрегая величиной Δ Н, имеем ΔG = – TΔS, т. е. самопроизвольно будут идти процессы с увеличением энтропии, для которых ΔS > 0, a ΔG < 0. При этом чем больше по абсолютной величине значение ΔG, тем более полно проходит данный процесс.
Величина AG для той или иной реакции может быть определена по формуле:
ΔG = ΔС обр(продуктов) – ΔG o б p(реагентов).
При этом величины ΔG o бр, а также Δ Н обр и ΔS o брдля большого числа веществ приведены в специальных таблицах.
4.2. Химическая кинетика
Скорость химической реакции( v ) определяется изменением молярной концентрации реагирующих веществ в единицу времени:
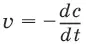
где v – скорость реакции, с – молярная концентрация реагента, t – время.
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции (температуры, концентрации, присутствия катализатора и т. д.)
Влияние концентрации. Вслучае простых реакций скорость реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
Для реакции
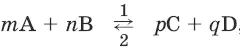
где 1 и 2 соответственно направление прямой и обратной реакции:
v 1= k 1× [А] m × [В] nи
v 2= k 2 × [C] p × [D] q
где v – скорость реакции, k – константа скорости, [А] – молярная концентрация вещества А.
Молекулярность реакции– число молекул, участвующих в элементарном акте реакции. Для простых реакций, например: mA + nB → рС + qD, молекулярность равна сумме коэффициентов (m + n). Реакции могут быть одномолекулярными, двумолекулярными и редко трехмолекулярными. Реакции более высокой молекулярности не встречаются.
Порядок реакцииравен сумме показателей степеней концентрации в экспериментальном выражении скорости химической реакции. Так, для сложной реакции
mA + nB → рС + qD экспериментальное выражение скорости реакции имеет вид
v 1= k 1 × [А] α × [В] βи порядок реакции равен (α + β). При этом α и β находятся экспериментально и могут не совпадать с m и n соответственно, поскольку уравнение сложной реакции представляет собой итог нескольких простых реакций.
Влияние температуры.Скорость реакции зависит от числа эффективных столкновений молекул. Увеличение температуры увеличивает число активных молекул, сообщая им необходимую для протекания реакции энергию активацииЕ акти увеличивает скорость химической реакции.
Правило Вант-Гоффа.При увеличении температуры на 10° скорость реакции увеличивается в 2–4 раза. Математически это записывается в виде:
v 2= v 1 × γ (t 2 – t 1)/10
где v 1и v 2– скорости реакции при начальной (t 1) и конечной (t 2) температурах, γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции при увеличении температуры на 10°.
Более точно зависимость скорости реакции от температуры выражается уравнением Аррениуса:
k = A × e — E/(RT),
где k – константа скорости, А – постоянная, не зависящая от температуры, е = 2,71828, Е – энергия активации, R = 8,314 Дж/(К × моль) – газовая постоянная; Т – температура (К). Видно, что константа скорости увеличивается с увеличением температуры и уменьшением энергии активации.
4.3. Химическое равновесие
Система находится в равновесии, если ее состояние не изменяется во времени. Равенство скоростей прямой и обратной реакции – условие сохранения равновесия системы.
Примером обратимой реакции является реакция
N 2+ 3H 2 ↔ 2NH 3.
Закон действия масс:отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ (все концентрации указывают в степенях, равных их стехиометрическим коэффициентам) есть постоянная, называемая константой равновесия.
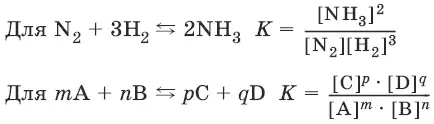
Константа равновесия – это мера протекания прямой реакции.
К = О – прямая реакция не идет;
К = ∞ – прямая реакция идет до конца;
К > 1 – равновесие сдвинуто вправо;
К < 1 – равновесие сдвинуто влево.
Константа равновесия реакции К связана с величиной изменения стандартной энергии Гиббса ΔG для этой же реакции:
ΔG = – RT ln K, или ΔG = -2,3RT lg K, или К= 10 -0,435ΔG/RT
Если К > 1, то lg K > 0 и ΔG < 0, т. е. если равновесие сдвинуто вправо, то реакция – переход от исходного состояния к равновесному – идет самопроизвольно.
Если К < 1, то lg K < 0 и ΔG > 0, т. е. если равновесие сдвинуто влево, то реакция самопроизвольно вправо не идет.
Закон смещения равновесия:если на систему, находящуюся в равновесии, оказывается внешнее воздействие, в системе возникает процесс, который противодействует внешнему воздействию.
5. Окислительно-восстановительные реакции
Окислительно-восстановите льные реакции– реакции, которые идут с изменением степеней окисления элементов.
Окисление– процесс отдачи электронов.
Восстановление– процесс присоединения электронов.
Окислитель– атом, молекула или ион, который принимает электроны.
Восстановитель– атом, молекула или ион, который отдает электроны.
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





