М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Многоосновные кислоты диссоциируют ступенчато:
Н 3PO 4 ↔ Н ++ Н 2PO 4¯
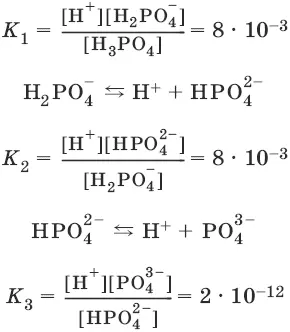
Константа равновесия суммарной реакции диссоциации равна произведению констант отдельных стадий диссоциации:
Н 3PO 4 ↔ ЗН ++ PO 4 3-
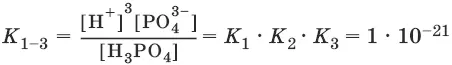
Закон разбавления Оствальда:степень диссоциации слабого электролита (а) увеличивается при уменьшении его концентрации, т. е. при разбавлении:
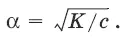
Влияние общего иона на диссоциацию слабого электролита:добавление общего иона уменьшает диссоциацию слабого электролита. Так, при добавлении к раствору слабого электролита CH 3COOH
CH 3COOH ↔ CH 3COО¯ + Н + α << 1
сильного электролита, содержащего общий с CH 3COOH ион, т. е. ацетат-ион, например CH 3COОNa
CH 3COОNa ↔ CH 3COО¯ + Na + α = 1
концентрация ацетат-иона увеличивается, и равновесие диссоциации CH 3COOH сдвигается влево, т. е. диссоциация кислоты уменьшается.
6.4. Диссоциация сильных электролитов
Активность иона а – концентрация иона, проявляющаяся в его свойствах.
Коэффициент активности f – отношение активности иона а к концентрации с: f = а/с или а =fc.
Если f = 1, то ионы свободны и не взаимодействуют между собой. Это имеет место в очень разбавленных растворах, в растворах слабых электролитов и т. д.
Если f < 1, то ионы взаимодействуют между собой. Чем меньше f, тем больше взаимодействие между ионами.
Коэффициент активности зависит от ионной силы раствора I: чем больше ионная сила, тем меньше коэффициент активности.
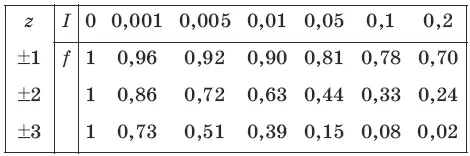
Ионная сила раствора I зависит от зарядов z и концентраций с ионов:
I = 0,52Σс • z 2.
Коэффициент активности зависит от заряда иона: чем больше заряд иона, тем меньше коэффициент активности. Математически зависимость коэффициента активности f от ионной силы I и заряда иона z записывается с помощью формулы Дебая-Хюккеля:
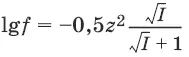
Коэффициенты активности ионов можно определить с помощью следующей таблицы:
6.5 Ионное произведение воды. Водородный показатель
Вода – слабый электролит – диссоциирует, образуя ионы Н +и OH¯. Эти ионы гидратированы, т. е. соединены с несколькими молекулами воды, но для простоты их записывают в негидратированной форме
Н 2O ↔ Н ++ OH¯.
На основании закона действия масс, для этого равновесия:
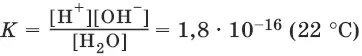
Концентрацию молекул воды [Н 2O], т. е. число молей в 1 л воды, можно считать постоянной и равной [Н 2O] = 1000 г/л : 18 г/моль = 55,6 моль/л. Отсюда:
К • [Н 2O] = К (Н 2O ) = [Н +] • [OH¯] = 10 -14(22°C).
Ионное произведение воды– произведение концентраций [Н +] и [OH¯] – есть величина постоянная при постоянной температуре и равная 10 -14при 22°C.
Ионное произведение воды увеличивается с увеличением температуры.
Водородный показатель рН– отрицательный логарифм концентрации ионов водорода: рН = – lg[H +]. Аналогично: pOH = – lg[OH¯].
Логарифмирование ионного произведения воды дает: рН + рOH = 14.
Величина рН характеризует реакцию среды.
Если рН = 7, то [Н +] = [OH¯] – нейтральная среда.
Если рН < 7, то [Н +] > [OH¯] – кислотная среда.
Если рН > 7, то [Н +] < [OH¯] – щелочная среда.
6.6. Буферные растворы
Буферные растворы – растворы, имеющие определенную концентрацию ионов водорода. рН этих растворов не меняется при разбавлении и мало меняется при добавлении небольших количеств кислот и щелочей.
I. Раствор слабой кислоты НА, концентрация – с кисл, и ее соли с сильным основанием ВА, концентрация – с соли. Например, ацетатный буфер – раствор уксусной кислоты и ацетата натрия: CH 3COOH + CHgCOONa.
рН = рК кисл+ lg(с соли/с кисл).
II. Раствор слабого основания ВOH, концентрация – с осн, и его соли с сильной кислотой ВА, концентрация – с соли. Например, аммиачный буфер – раствор гидроксида аммония и хлорида аммония NH 4OH + NH 4Cl.
рН = 14 – рК осн– lg(с соли/с осн).
6.7. Гидролиз солей
Гидролиз солей– взаимодействие ионов соли с водой с образованием слабого электролита.
Примеры уравнений реакций гидролиза.
I. Соль образована сильным основанием и слабой кислотой:
Na 2CO 3+ H 2O ↔ NaHCO 3+ NaOH
2Na ++ CO 3 2-+ H 2O ↔ 2Na ++ HCO 3¯ + OH¯
CO 3 2-+ H 2O ↔ HCO 3¯ + OH¯, pH > 7, щелочная среда.
По второй ступени гидролиз практически не идет.
II. Соль образована слабым основанием и сильной кислотой:
AlCl 3+ H 2O ↔ (AlOH)Cl 2+ HCl
Al 3++ ЗCl¯ + H 2O ↔ AlOH 2++ 2Cl¯ + Н ++ Cl¯
Al 3++ H 2O ↔ AlOH 2++ Н +, рН < 7.
По второй ступени гидролиз идет меньше, а по третьей ступени практически не идет.
III. Соль образована сильным основанием и сильной кислотой:
KNO 3+ H 2O ≠
К ++ NO 3¯ + Н 2O ≠ нет гидролиза, рН ≈ 7.
IV. Соль образована слабым основанием и слабой кислотой:
CH 3COONH 4+ H 2O ↔ CH 3COOH + NH 4OH
CH 3COO¯ + NH 4 ++ H 2O ↔ CH 3COOH + NH 4OH, рН = 7.
В ряде случаев, когда соль образована очень слабыми основаниями и кислотами, идет полный гидролиз. В таблице растворимости у таких солей символ – «разлагаются водой»:
Al 2S 3+ 6Н 2O = 2Al(OH) 3↓ + 3H 2S↑
Возможность полного гидролиза следует учитывать в обменных реакциях:
Al 2(SO 4) 3+ 3Na 2CO 3+ 3H 2O = 2Al(OH) 3↓ + 3Na 2SO 4+ 3CO 2↑
Степень гидролиза h – отношение концентрации гидролизованных молекул к общей концентрации растворенных молекул.
Для солей, образованных сильным основанием и слабой кислотой:
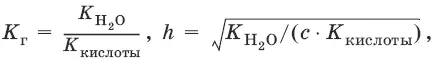
[OH¯] = ch, рOH = – lg[OH¯], рН = 14 – рOH.
Из выражения следует, что степень гидролиза h (т. е. гидролиз) увеличивается:
а) с увеличением температуры, так как увеличивается K(H 2O);
б) с уменьшением диссоциации кислоты, образующей соль: чем слабее кислота, тем больше гидролиз;
в) с разбавлением: чем меньше с, тем больше гидролиз.
Для солей, образованных слабым основанием и сильной кислотой
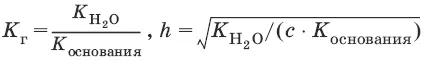
[Н +] = ch, рН = – lg[H +].
Для солей, образованных слабым основанием и слабой кислотой
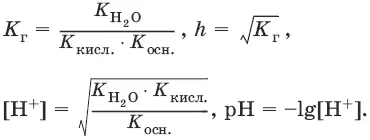
6.8. Протолитическая теория кислот и оснований
Интервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





