Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Электрохимическое выделение водорода из кислых растворов происходит вследствие разряда ионов водорода. В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды:
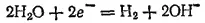
* К важнейшим условиям электролиза относятся плотность тока, температура, состав раствора. Плотностью тока называется отношение силы тока к рабочей площади электрода.
- 287 -
Таким образом, характер катодного процесса при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений. В ряде случаев большое значение имеют pH раствора, концентрация ионов металла и другие условия электролиза.
При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза. Активным называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще всего применяют графит, уголь, платину.
На инертном аноде при электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также фторо-водорода и фторидов происходит электрохимическое окисление воды с выделением кислорода. В зависимости от pH раствора этот процесс протекает по-разному и может быть записан различными уравнениями. В щелочной среде уравнение имеет вид
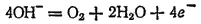
а в кислой или нейтральной:
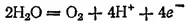
В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом. Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона SO 4 2-
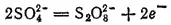
равен 2,01 В, что значительно превышает стандартный потенциал окисления воды (1,229 В). Стандартный потенциал окисления иона F- имеет еще большее значение (2,866 В).
При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы. В частности, при электролизе растворов HI,HBr, HCl и их солей у анода выделяется соответствующий галоген. Отметим, что выделение хлора при электролизе HCl и ее солей противоречит взаимному положению систем
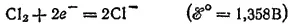
и
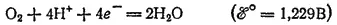
в ряду стандартных электродных потенциалов.
Эта аномалия связана со значительным перенапряжением (см. § 104) второго и этих двух электродных процессов — материал анода оказывает тормозящее действие на процесс выделения кислорода.
- 288 -
В случае активного анода число конкурирующих окислительных процессов возрастает до трех: электрохимическое окисление воды с выделением кислорода, разряд аниона (т. е. его окисление) и электрохимическое окисление металла анода (так называемое анодное растворение металла). Из этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона.
Рассмотрим несколько типичных случаев электролиза водных растворов.
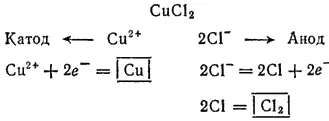
Электролиз раствора CuCl 2с инертным анодом. Медь в ряду напряжений расположена после водорода: поэтому у катода будет происходить разряд ионов Cu 2+и выделение металлической меди. У анода будут разряжаться хлорид-ионы.
Схема электролиза раствора хлорида меди(II):
Электролиз раствора K 2SO 4с инертным анодом. Поскольку калий в ряду напряжений стоит значительно раньше водорода, то у катода будет происходить выделение водорода и накопление ионов OH-. У анода будет идти выделение кислорода и накопление ионов H+. В то же время в катодное пространство будут приходить ионы K+, а в анодное — SO 4 2-. Таким образом, раствор во всех его частях будет оставаться электронейтральным. Однако в катодном пространстве будет накапливаться щелочь, а в анодном — кислота.
Схема электролиза раствора сульфата калия:
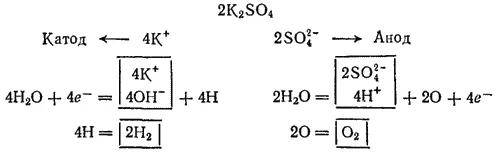
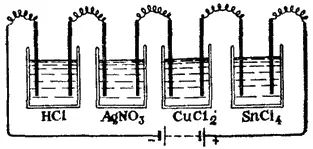
Рис. 86. Схема установки иллюстрирующей, закон Фарадея.
- 289 -
Электролиз раствора NiSO 4с никелевым анодом. Стандартный потенциал никеля (-0.250 В) несколько больше, чем —0,41 В; поэтому при электролизе нейтрального раствора NiSO 4на катоде в основном происходит разряд ионов Ni 2+и выделение металла. На аноде происходит противоположный процесс — окисление металла, так как потенциал никеля намного меньше потенциала окисления воды, а тем более — потенциала окисления иона SO 4 2-. Таким образом, в данном случае электролиз сводится к растворению металла анода и выделению его на катоде.
Схема электролиза раствора сульфата никеля:
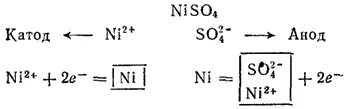
Этот процесс применяется для электрической очистки никеля (так называемое электролитическое рафинирование, см. § 103).
102. Законы электролиза.
С количественной стороны процесс электролиза впервые был изучен в 30-x годах XIX века выдающимся английским физиком Фарадеем, который в результате своих исследований установил следующие законы электролиза:
1. Масса образующегося при электролизе вещества пропорциональна количеству прошедшего через раствор электричества.
Этот закон вытекает из сущности электролиза. Как уже говорилось, в месте соприкосновения металла с раствором происходит электрохимический процесс—взаимодействие ионов или молекул электролита с электронами металла, так что электролитическое образование вещества является результатом этого процесса. Ясно, что количество вещества, получающегося у электрода, всегда будет пропорционально числу прошедших по цепи электронов, т. е. количеству электричества.
Читать дальшеИнтервал:
Закладка:








