Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
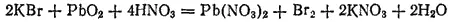
Запишем уравнение реакции в ионно-молекулярной форме:
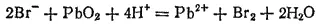
В табл. 18 находим стандартные электродные потенциалы электрохимических систем, участвующих в реакции:
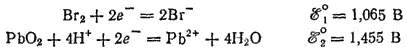
Окислителем всегда служит электрохимическая система с более высоким значением электродного потенциала. Поскольку здесь ℰ° 2значительно больше, чем ℰ° 1, то практически при любых концентрациях взаимодействующих веществ бромид-ион будет служить восстановителем и окисляться диоксидом свинца: реакция будет самопроизвольно протекать слева направо.
Чем дальше находится та или иная система в ряду стандартных потенциалов, т. е. чем больше ее стандартный потенциал, тем более сильным окислителем является ее окисленная форма.
- 281 -
И, наоборот, чем раньше расположена система в ряду, т. е. чем меньше значение ℰ°, тем более сильный восстановитель ее восстановленная форма. Действительно, среди окисленных форм систем конца ряда мы находим такие сильные окислители, как F 2, H 2O 2, MnO 4 -. Самые же сильные восстановители — восстановленные формы систем начала ряда: щелочные и щелочноземельные металлы.
При протекании окислительно-восстановительных реакций концентрации исходных веществ падают, а продуктов реакции — возрастают. Это приводит к изменению величин потенциалов обеих полуреакций: электродный потенциал окислителя падает, а электродный потенциал восстановителя возрастает. Когда потенциалы обоих процессов становятся равными друг другу, реакция заканчивается — наступает состояние химического равновесия.
100. Ряд напряжений металлов.
Если из всего ряда стандартных электродных потенциалов выделить только те электродные процессы, которые отвечают общему уравнению
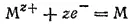
то получим ряд напряжений металлов. В этот ряд всегда помешают, кроме металлов, также водород, что позволяет видеть, какие металлы способны вытеснять водород из водных растворов кислот.
Таблица 19. Ряд напряжений металлов

Ряд напряжений для важнейших металлов приведен в табл. 19. Положение того или иного металла в ряду напряжений характеризует его способность к окислительно-восстановительным взаимодействиям в водных растворах при стандартных условиях. Ионы металлов являются окислителями, а металлы в виде простых веществ — восстановителями. При этом, чем дальше расположен металл в ряду напряжений, тем более сильным окислителем в водном растворе являются его ионы, и наоборот, чем ближе металл к началу ряда, тем более сильные восстановительные свойства проявляет простое вещество — металл.
Потенциал электродного процесса
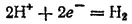
в нейтральной среде (pH=7) равен -0.059·7= -0.41 В (см. стр. 273). Активные металлы начала ряда, имеющие потенциал, значительно более отрицательный, чем —0,41 В, вытесняют водород из воды. Магний вытесняет водород только из горячей воды. Металлы, расположенные между магнием и кадмием, обычно не вытесняют водород из воды. На поверхности этих металлов образуются оксидные пленки, обладающие защитным действием*.
Металлы, расположенные между магнием и водородом, вытесняют водород из растворов кислот. При этом на поверхности некоторых металлов также образуются защитные пленки, тормозящие реакцию. Так, оксидная пленка на алюминии делает этот металл стойким не только в воде, но и в растворах некоторых кислот. Свинец не растворяется в серной кислоте при ее концентрации ниже 80%, так как образующаяся при взаимодействии свинца с серной кислотой соль PbSO 4нерастворима и создает на поверхности металла защитную пленку. Явление глубокого торможения окисления металла, обусловленное наличием на его поверхности защитных оксидных или солевых пленок, называется пассивностью, а состояние металла при этом — пассивным состоянием.
Металлы способны вытеснять друг друга из растворов солей. Направление реакции определяется при этом их взаимным положением в ряду напряжений. Рассматривая конкретные случаи таких реакций, следует помнить, что активные металлы вытесняют водород не только из воды, но и из любого водного раствора. Поэтому взаимное вытеснение металлов из растворов их солей практически происходит лишь в случае металлов, расположенных в ряду после магния.
- 283 -
Вытеснение металлов из их соединений другими металлами впервые подробно изучал Бекетов. В результате своих работ он расположил металлы по их химической активности в вытеснительный ряд», являющийся прототипом ряда напряжений металлов.
Взаимное положение некоторых металлов в ряду напряжений и в периодической системе на первый взгляд не соответствует друг, другу. Например, согласно положению в периодической системе химическая активность калия должна быть больше, чем натрия, а натрия — больше, чем лития. В ряду же напряжений наиболее активным оказывается литий, а калий занимает среднее положение между литием и натрием. Цинк и медь по их положению в периодической системе должны иметь приблизительно равную химическую активность, но в ряду напряжений цинк расположен значительно раньше меди. Причина такого рода несоответствий состоит в следующем.
При сравнении металлов, занимающих то или иное положение в периодической системе, за меру их химической активности — восстановительной способности — принимается величина энергии ионизации свободных атомов. Действительно, при переходе, например, сверху вниз по главной подгруппе I группы периодической системы энергия ионизации атомов уменьшается, что связано с увеличением их радиусов (т. е. с большим удалением внешних электронов от ядра) и с возрастающим экранированием положительного заряда ядра промежуточными электронными слоями (см. § 31). Поэтому атомы калия проявляют большую химическую активность — обладают более сильными восстановительными свойствами, - чем атомы натрия, а атомы натрия — большую активность, чем атомы лития.
При сравнении же металлов в ряду напряжений за меру химической активности принимается работа превращения металла, находящегося в твердом состоянии, в гидратированные ионы в водном растворе. Эту работу можно представить как сумму трех слагаемых: энергии атомизации — превращения кристалла металла в изолированные атомы, энергии ионизации свободных атомов металла и энергии гидратации образующихся ионов. Энергия атомизации характеризует прочность кристаллической решетки данного металла. Энергия ионизации атомов — отрыва от них валентных электронов — непосредственно определяется положением металла в периодической системе. Энергия, выделяющаяся при гидратации, зависит от электронной структуры иона, его заряда и радиуса.
Читать дальшеИнтервал:
Закладка:








