Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
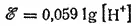
или, учитывая, что lg[H+]=-pH, окончательно получим:
- 274 -
Для определения потенциала того или иного электродного процесса нужно составить гальванический элемент из испытуемого и стандартного водородного электродов и измерить его э. д. с. Поскольку потенциал стандартного водородного электрода равен нулю, то измеренная э. д. с будет представлять собою потенциал данного электродного процесса.
Практически при измерениях потенциалов в качестве электрода сравнения пользуются не стандартным водородным, а другими электродами, более удобными в обращении, потенциалы которых по отношению к стандартному водородному электроду известны. При этом необходимо рассчитать э. д. с. элемента согласно уравнению:
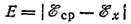
Здесь Е — э.д.с. элемента; ℰ ср— известный потенциал электрода сравнения; ℰ x- потенциал испытуемого электрода.
Решая уравнение относительно ℰ xполучаем:

В качестве электродов сравнения чаще всего применяют хлор-серебряный и каломельный электроды. Хлорсеребряный электрод — это серебряная проволочка, покрытая слоем AgCl и погруженная в раствор соляной кислоты или ее соли. При замкнутой цепи на нем протекает реакция:
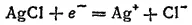
Каломельный электрод представляет собой ртуть, покрытую взвесью каломели Hg 2Cl 2в растворе KCl. Потенциалы этих электродов воспроизводятся с высокой точностью. На рис. 85 изображена цепь с каломельным электродом.
Для того чтобы найти значение электродного потенциала, необходимо измерить не напряжение работающего элемента, а именно его э. д. с. При измерениях э. д. с. сопротивление внешней цепи (т. е. измерительного устройства) очень велико. Реакция в элементе при этом практически не протекает. Таким образом, электродные потенциалы отвечают обратимому протеканию процессов или, что то же самое, состоянию электрохимического равновесия на электродах. Поэтому электродные потенциалы часто называют равновесными электродными потенциалами или просто равновесными потенциалами.
Рассмотрим теперь, какой вид принимает общее уравнение электродного потенциала в важнейших случаях.
1. Электродный процесс выражается уравнением
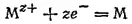
где М обозначает атомы какого-либо металла, M z+- его z-зарядные ионы.
- 275 -
К этому случаю относятся оба электрода медно-цинкового элемента и вообще любой металлический электрод в растворе соли этого же металла. Здесь окисленной формой металла являются его ионы, а восстановленной — атомы. Следовательно, [Ox]=[M z+], так как концентрация атомов в металле при постоянной температуре — величина постоянная. Включая значение этой постоянной в величину ℰ° получим:
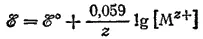
Например, для процесса Ag ++ e -=Ag
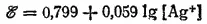
а для процесса Zn 2++ 2e -=Zn
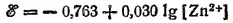
2, Электродный процесс выражается уравнением:
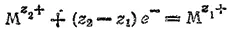
В этом случае и окисленная (M z 2+) и восстановленная (M z 1+) формы металла находятся в растворе и их концентрации —величины переменные. Поэтому
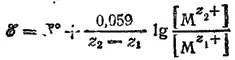
Например, для процесса Fe 3++ e -= Fe 2+:
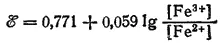
В этом и в рассматриваемых ниже случаях электрод, на котором протекает электродный процесс, изготовляется из инертного материала. Чаще всего в качестве такого материала применяют платину.
Мы рассмотрели примеры, когда в электродных процессах принимали участие только ионы, состоящие из одного элемента. Однако часто окисляющееся или восстанавливающееся вещество состоит не из одного, а из двух или большего числа элементов. Чаще всего в составе окислителя содержится кислород; при этом в электродном процессе обычно принимают участие также вода и продукты ее диссоциации — ионы водорода (в кислой среде) или гидроксид-ионы (в щелочной среде). Рассмотрим, как будут выглядеть в таких случаях уравнения потенциалов электродных процессов.
3. Электродный процесс выражается уравнением:
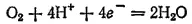
- 276 -
Эта полуреакция (при протекании ее в сторону восстановления) играет очень большую роль при коррозии металлов (см. § 196). Кислород — самый распространенный окислитель, вызывающий коррозию металлов в водных средах.
В рассматриваемом электродном процессе в результате восстановления кислорода, протекающего с участием ионов водорода, образуется вода. Следовательно, [Red]=[H 2O] 2, а [Ox]=[O 2][H +] 4. Концентрацию воды в разбавленных растворах можно считать постоянной. Концентрация кислорода в растворе пропорциональна его парциальному давлению над раствором ([O 2]=dp O 2). Выполнив необходимые преобразования и обозначив сумму постоянных величин через ℰ°, получим:
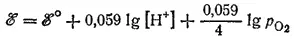
Для рассматриваемого процесса ℰ° =1.228 B; следовательно
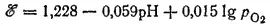
При парциальном давлении кислорода, равном нормальному атмосферному давлению (которое условно принимается равным единице), lg p O 2=0 и последнее уравнение принимает вид
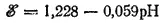
4. Для электродных процессов, записываемых более сложными уравнениями, в выражениях для потенциалов содержится большее число переменных концентраций. Рассмотрим, например, электродный процесс:
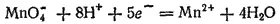
Интервал:
Закладка:








