Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Прямые опыты с применением радиоактивных индикаторов Показывают, что если привести металл (М) в контакт с раствором его соли, то ионы металла (M z+) переходят из металлической фазы в раствор и из раствора в металл. Поскольку энергетическое состояние ионов в этих фазах неодинаково, то в первый момент после установления контакта ионы металла переходят из металла в раствор и в обратном направлении с различной скоростью. Если преобладает переход ионов из металлической фазы в раствор, то раствор приобретает положительный заряд, а металлический электрод заряжается отрицательно. По мере увеличения этих зарядов переход катионов в одноименно заряженный раствор затрудняется, так что скорость этого процесса уменьшается, скорость же перехода катионов из раствора на отрицательно заряженный электрод возрастает. В результате скорости обоих процессов выравниваются и между металлом и раствором устанавливается равновесие:
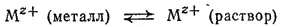
При этом металлический электрод оказывается заряженным отрицательно, а раствор — положительно. Если при установлении контакта металл — раствор скорость перехода катионов из металла в раствор была меньше, чем скорость их перехода в обратном направлении, то между электродом и раствором также устанавливается равновесие; но в этом случае электрод заряжается положительно, а раствор — отрицательно.
В элементе Якоби — Даниэля соответствующие равновесия устанавливаются между цинковым электродом и раствором сульфата цинка
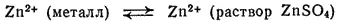
а также между медным электродом и раствором сульфата меди:
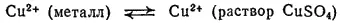
В этом элементе имеются еще две границы раздела фаз: между растворами сульфатов цинка и меди, а также медью и цинком (см. рис. 82). Граница между растворами не оказывает существенного влияния ни на величину э. д. с., ни на протекание реакции при работе элемента.
Что же касается границы между металлами, то через нее могут проходить не ионы, как в случае границы металл— раствор, а электроны. И здесь вследствие неодинакового энергетического состояния электронов в меди и в цинке первоначальные скорости перехода электронов из одного металла в другой и в обратном направлении различны. Однако и в этом случае быстро устанавливается равновесие, при котором металлы также приобретают заряды противоположного знака:

Таким образом, при разомкнутой цепи на трех имеющихся в элементе Якоби — Даниэля границах раздела фаз устанавливаются равновесия, причем фазы заряжаются. В результате энергетическое состояние электронов на концах разомкнутой цепи-оказывается неодинаковым: на том медном проводнике, который соприкасается с цинковым электродом, энергия Гиббса электронов выше, а на том, который соединен с медным электродом, — ниже. Разность энергий Гиббса электронов на концах цепи и определяет э.д.с. данного элемента.
При замыкании внешней цепи электроны перемещаются от цинкового электрода к медному. Поэтому равновесия на фазовых границах нарушаются; происходит направленный переход ионов цинка из металла в раствор, ионов меди — из раствора в металл, электронов — от цинка к меди: протекает окислительно-восстановительная реакция.
В принципе электрическую энергию может дать любая окислительно-восстановительная реакция. Однако число реакций, практически используемых в химических источниках электрической энергии, невелико. Это связано с тем, что не всякая окислительно-восстановительная реакция позволяет создать гальванический элемент, обладающий технически ценными свойствами (высокая и практически постоянная э.д.с., возможность отбирания больших токов, длительная сохранность и др.). Кроме того, многие окислительно-восстановительные реакции требуют расхода дорогостоящих веществ.
В отличие от медно-цинкового элемента, во всех современных гальванических элементах и аккумуляторах используют не два, а один электролит; такие источники тока значительно удобнее в эксплуатации. Например, в свинцовых аккумуляторах (см. § 189) электролитом служит раствор серной кислоты.
Почти во всех выпускаемых в настоящее время гальванических элементах анод изготовляется из цинка, а в качестве вещества для катода обычно применяются оксиды менее активных металлов.
- 270 -
Описание важнейших гальванических элементов см. § 214, аккумуляторов — пп. 189, 201, 244.
Химические источники электрической энергии применяются в различных отраслях техники. В средствах связи (радио, телефон, телеграф) и в электроизмерительной аппаратуре они служат источниками электропитания, на автомобилях, самолетах, тракторах применяются для приведения в действие стартеров и других устройств, на транспорте, в переносных фонарях с их помощью производится освещение.
Все обычные ХИЭЭ не свободны от двух недостатков. Во-первых, стоимость веществ, необходимых для их работы (например, свинца, кадмия), высока. Во-вторых, отношение количества энергии, которую может отдать элемент, к его массе мало. На протяжении последних десятилетий ведутся исследования, направленные на создание элементов, при работе которых расходовались бы дешевые вещества с малой плотностью, подобные жидкому или газообразному топливу (природный газ, керосин, водород и др.). Такие гальванические элементы называются топливными. Проблеме топливного элемента уделяется в настоящее время большое внимание и можно полагать, что в ближайшем будущем топливные элементы найдут широкое применение.
99. Электродные потенциалы.
Каждая окислительно-восстановительная реакция слагается из полуреакций окисления и восстановления. Когда реакция протекает в гальваническом элементе или осуществляется путем электролиза, то каждая полуреакция протекает на соответствующем электроде; поэтому полуреакции называют также электродными процессами.
В § 98 было показано, что протекающей в гальваническом элементе окислительно-восстановительной реакции соответствует э.д.с. этого элемента Е, связанная с изменением энергии Гиббса ΔG реакции уравнением:
ΔG = -zFE
В соответствии с разделением окислительно-восстановительной реакции на две полуреакции, электродвижущие силы также принято представлять в виде разности двух величии, каждая из которых отвечает данной полуреакции. Эти величины называются электродными потенциалами.
Читать дальшеИнтервал:
Закладка:








