Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
При работе элемента, т. е. при замкнутой цепи, цинк окисляется: на поверхности его соприкосновения с раствором атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи к медному электроду. Вся совокупность этих процессов схематически изображается уравнением полуреакции, или электрохимическим уравнением:
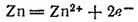
На медном электроде протекает восстановление ионов меди. Электроны, приходящие сюда от цинкового электрода, соединяются с выходящими из раствора дегидратирующимися ионами меди; образуются атомы меди, выделяющиеся в виде металла. Соответствующее электрохимическое уравнение имеет вид:
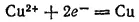
Суммарное уравнение реакции, протекающей в элементе, получится при сложении уравнений обеих полуреакций. Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов.
Направление движения ионов в растворе обусловлено протекающими у электродов электрохимическими процессами. Как уже сказано, у цинкового электрода катионы выходят в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор, наоборот, все время обедняется катионами, так что здесь раствор заряжается отрицательно. В результате этого создается электрическое поле, в котором катионы, находящиеся в растворе (Cu 2+и Zn 2+) , движутся от цинкового электрода к медному, а анионы SO 4 2-в обратном направлении. В итоге жидкость у обоих электродов остается электронейтральной. Схема движения электронов и ионов при работе медно-цинкового элемента показана на рис. 83.
Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом. В медно-цинковом элементе цинковый электрод является анодом, а медный — катодом.
- 266 -
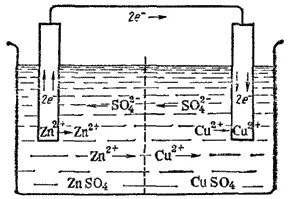
Рис. 82. Схема медно-цинкового гальванического элемента.
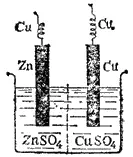
Рис. 83. Схема движения ионов и электронов при работе медно-цинкового гальванического элемента.
Протекающая в гальваническом элементе окислительно-восстановительная реакция представляет собой сложный процесс. Она включает собственно электрохимические стадии (превращения атомов, ионов или молекул на электродах), перенос электронов, перенос ионов. Все эти стадии сопряжены между собой и протекают с одной и той же скоростью; число электронов, которые за единицу времени отдает цинк, равно числу электронов, принимаемых за это же время ионами меди. Поэтому скорость реакции, протекающей в гальваническом элементе, пропорциональна количеству электричества, перенесенного по цепи в единицу времени, т. е. силе тока в цепи.
Электрический ток, протекающий по внешней цепи гальванического элемента, может производить полезную, работу. Но работа, которую можно выполнить за счет энергии химической реакции, зависит от ее скорости: она максимальна при бесконечно медленном — обратимом — проведении реакции (см. § 67). Следовательно, работа, которую можно произвести за счет реакции, протекающей в гальваническом элементе, зависит от величины отбираемого от него тока. Если, увеличивая сопротивление внешней цепи, уменьшать ток до бесконечно малого значения, то и скорость реакции в элементе тоже будет бесконечно малой, а работа - максимальной. Теплота, выделяемая во внутренней цепи элемента, будет при этом, наоборот, минимальна.
Работа электрического тока выражается произведением количества прошедшего по цепи электричества на напряжение. В медно-цинковом элементе при окислении одного эквивалента цинка и Одновременном восстановлении одного эквивалента ионов меди по цепи пройдет количество электричества, численно равное одному фарадею ( F=96485 Кл/моль), так что полезная работа A', которую ток может совершить, будет равна:
- 267 -
A' = FV
где V — напряженке между полюсами элемента.
Но поскольку эта работа зависит от силы тока, то и напряжение между полюсами элемента тоже зависит от силы тока (F - величина постоянная). В предельном случае, отвечающем обратимому протеканию реакции, напряжение будет максимальным. Максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции, называется электродвижущей силой (э. д. с.) данного элемента.
Для этого предельного случая полезная работа, производимая электрическим током в медно-цинковом элементе при взаимодействии одного эквивалента цинка с одним эквивалентом ионов меди, выразится уравнением
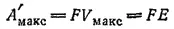
где E ≡ V макс- э. д. с. элемента.
Ясно, что при взаимодействии одного моля атомов цинка с одним молем ионов меди уравнение примет вид:
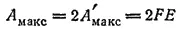
В общем случае при растворении (или выделении) одного моля вещества, ионы которого имеют заряд, равный z, максимальная полезная работа связана с э. д. с. уравнением:
A макс= zFE
При постоянных температуре и давлении максимальная полезная работа реакции равна взятому с обратным знаком изменению энергии Гиббса ΔG (см. § 67). Отсюда:
ΔG = -zFE
Если концентрации (точнее говоря, активности) веществ, участвующих в реакции, равны единице, т. е. если соблюдаются стандартные условия, то э.д.с. элемента называется его стандартной электродвижущей силой и обозначается E°. При этом последнее уравнение принимает вид:
ΔG° = -zFE°
Учитывая, что стандартное изменение энергии Гиббса реакции связано с ее константой равновесия (см. § 68) соотношением
ΔG° = -RT ln K
получим уравнение, связывающее стандартную э. д. с. с константой равновесия реакции, протекающей в гальваническом элементе:
RT ln K = zFE°
- 268 -
Измерения электродвижущих сил можно производить с высокой точностью. Эти измерения представляют собой один из наиболее точных методов определения стандартных энергий Гиббса, а следовательно, и констант равновесия окислительно-восстановительных реакций в растворах.
Окислительно-восстановительная реакция протекает в гальваническом элементе несмотря на то, что окислитель и восстановитель непосредственно друг с другом не соприкасаются. Для того чтобы понять, как это происходит, как возникает электродвижущая сила при пространственном разделении процессов окисления и восстановления, рассмотрим более детально явления, происходящие на границах раздела фаз в гальваническом элементе.
Читать дальшеИнтервал:
Закладка:








