Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
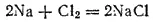
Эта реакция, как всякая гетерогенная реакция, протекает в несколько стадий. В ходе одной из них атомы натрия превращаются в положительно заряженные ионы; степень окисленности натрия изменяется от 0 до +1:
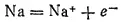
Такой процесс — отдача электронов, сопровождающаяся повышением степени окисленности элемента, - называется окислением.
Электроны, отдаваемые натрием, принимаются атомами хлора, которые превращаются при этом в отрицательно заряженные ионы; степень окисленности хлора изменяется от 0 до —1:
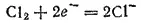
Присоединение электронов, сопровождающееся понижением степени окисленности элемента, называется восстановлением.
Таким образом, в рассматриваемой реакции натрий окисляется, а хлор восстанавливается.
Вещество, в состав которого входит окисляющийся элемент, называется восстановителем, а вещество, содержащее восстанавливающийся элемент, окислителем, Следовательно, в данном примере натрий — восстановитель, а хлор — окислитель.
Из уравнений процессов восстановления и окисления видно, что одна молекула хлора, восстанавливаясь, присоединяет два электрона, а окисление одного атома натрия сопровождается отдачей одного электрона. Общее число электронов в системе при химических реакциях не изменяется: число электронов, отдаваемых молекулами (атомами, ионами) восстановителя, равно числу электронов, присоединяемых молекулами (атомами, ионами) окислителя. Поэтому одна молекула хлора может окислить два атома натрия.
95. Составление уравнений окислительно-восстановительных реакций.
В § 94 мы рассмотрели простейший пример окислительно-восстановительной реакции — образование соединения из двух простых веществ. Обычно уравнения окислительно-восстановительных реакций носят более сложный характер и расстановка коэффициентов в них часто представляет довольно трудную задачу; приведем несколько примеров.
- 258 -
Пример 1. Взаимодействие между иодоводородом и концентрированной серной кислотой. Эта реакция протекает согласно схеме:
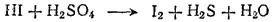
Если мы подсчитаем степень окисленности каждого элемента в исходных веществах и в продуктах реакции, то увидим, что она изменяется у иода и у серы. У иода в HI она равна —1, а в свободном иоде 0. Степень же окисленности серы изменяется от +6 (в H 2SO 4) до —2 (в H 2S). Таким образом, степень окисленности иода повышается, а серы — понижается. Следовательно, иод окисляется, а сера восстанавливается.
Уравнение процесса окисления иода имеет простой вид:
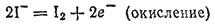
Уравнение восстановления серы более сложно, так как и исходное вещество (H 2SO 4или SO 4 2-), и продукт реакции (H 2S) кроме серы содержат другие элементы. При составлении этого уравнения будем исходить из того, что реакция протекает в кислой водной среде, а ион SO 4 2-превращается в молекулу H 2S:
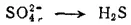
Четыре атома кислорода, высвобождающиеся при этом процессе, должны связаться в четыре молекулы воды. Для этого понадобятся восемь ионов водорода. Кроме того, два иона водорода необходимы для образования молекулы H 2S. Следовательно, с ионом SO 4 2-должны взаимодействовать десять ионов водорода:
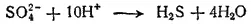
Суммарный заряд ионов, находящихся в левой части этой схемы, равен восьми элементарным положительным зарядам, а в правой ее части имеются лишь незаряженные частицы. Поскольку суммарный заряд в ходе процесса не изменяется, то, следовательно, в процессе восстановления принимают участие также восемь электронов:
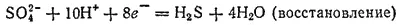
В рассматриваемом примере отношение числа электронов, принимаемых в процессе восстановления, к числу электронов, высвобождающихся при окислении, равно 4:1. Для получения суммарного уравнения реакции надо, складывая уравнения процессов восстановления и окисления, учесть это соотношение — умножить уравнение восстановления на 4. При этом в записи обычно справа от вертикальной черты проставляются необходимые множители:
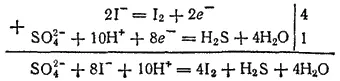
- 259 -
Полученное уравнение реакции может быть представлено и в молекулярной форме:
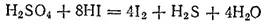
Пример 2. Взаимодействие алюминия с нитратом калия в щелочной среде. Схема реакции:
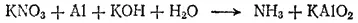
Здесь степень окисленности изменяется у азота и алюминия. Металлический алюминий (степень окисленности равна 0) превращается в ион AlO 2 -, в котором степень окисленности алюминия равна +3. Для составления уравнения окисления будем исходить из схемы:
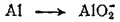
В щелочной среде источником кислорода, необходимого для протекания этого процесса, служат ионы OH -. Для связывания одного атома алюминия в AlO 2 -необходимо четыре гидроксид-иона:

В левой части схемы имеются четыре отрицательных заряда, а в правой — один. Следовательно, в ходе процесса отдаются три электрона:
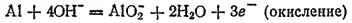
Для получения уравнения восстановления будем исходить из схемы:

Здесь в ходе процесса атомы азота лишаются атомов кислорода и связываются с атомами водорода. В щелочной среде это возможно при участии молекул воды. Три молекулы воды понадобятся для связывания трех атомов кислорода и еще три молекулы, воды — для образования молекулы NH 3:

Суммарный заряд правой части схемы равен девяти отрицательным зарядам, а левой — одному. Следовательно, в процессе принимают участие восемь электронов:
Читать дальшеИнтервал:
Закладка:








