Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:

которому отвечает константа:
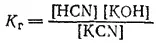
Разбавим раствор в 10 раз. В первый момент концентрации всех веществ — KCN, HCN и КОН — уменьшаются в 10 раз.
- 252 -
Вследствие этого числитель правой части уравнения константы гидролиза уменьшится в 100 раз, а знаменатель только в 10 раз. Но константа гидролиза, как всякая константа равновесия, не зависит от концентраций веществ. Поэтому равновесие в растворе нарушится. Для того чтобы оно вновь установилось, числитель дробя должен возрасти, а знаменатель — уменьшиться, т. е. некоторое количество соли должно дополнительно гидролизоваться. В результате этого концентрации HCN и КОН возрастут, а концентрация KCN — уменьшится. Таким образом, степень гидролиза соли увеличится.
Влияние температуры на степень гидролиза вытекает из принципа Ле Шателье. Все реакции нейтрализации протекают с выделением теплоты (§ 88), а гидролиз — с поглощением теплоты. Поскольку выход эндотермических реакций с ростом температуры увеличивается, то и степень гидролиза растет с повышением температуры.
Из сказанного ясно, что для ослабления гидролиза растворы следует хранить концентрированными и при низких температурах. Кроме того, подавлению гидролиза способствует падкисление (в случае солей, образованных сильной кислотой и слабым основанием) или подщелачивание (для солей, образованных сильным основанием и слабой кислотой) раствора.
Рассмотрим теперь гидролиз солей, образованных слабой многоосновной кислотой или слабым основанием многовалентного металла. Гидролиз таких солей протекает ступенчато. Так, первая ступень гидролиза карбоната натрия протекает согласно уравнению
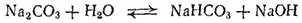
или в ионно-молекулярной форме:
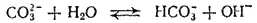
Образовавшаяся кислая соль в свою очередь подвергается гидролизу (вторая ступень гидролиза)
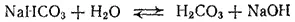
или
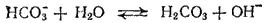
Как видно, при гидролизе по первой ступени образуется ион HCO 3 -, диссоциация которого характеризуется второй константой диссоциации угольной кислоты, а при гидролизе по второй ступени образуется угольная кислота, диссоциацию которой характеризует первая константа ее диссоциации. Поэтому константа гидролиза по первой ступени K r, 1связана со второй константой диссоциации кислоты, а константа гидролиза по второй ступени K r, 2, — с первой константой диссоциации кислоты.
- 253 -
Эта связь выражается соотношениями:

Поскольку первая константа диссоциации кислоты всегда больше второй, то константа гидролиза по первой ступени всегда больше, чем константа гидролиза по второй ступени:
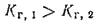
По этой причине гидролиз по первой ступени всегда протекает в большей степени, чем по второй. Кроме того, ионы, образующиеся при гидролизе по первой ступени (в рассмотренном примере — ионы OH-), способствуют смещению равновесия второй ступени влево, т. е. также подавляют гидролиз по второй ступени.
Аналогично проходит гидролиз солей, образованных слабым основанием многовалентного металла. Например, гидролиз хлорида меди(II) протекает по первой ступени с образованием хлорида гидроксомеди
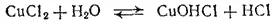
или в ионно-молекулярной форме:

Гидролиз по второй ступени происходит в ничтожно малой степени:
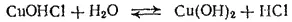
или
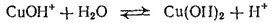
Особенно глубоко протекает гидролиз солей, образованных слабой кислотой и слабым основанием. Согласно вышеприведенному выражению, константа гидролиза в этом случае обратно пропорциональна произведению констант диссоциации кислоты и основания, т. е. ее значение особенно велико. Примером этого случая может служить гидролиз ацетата алюминия, протекающий до основных солей — ацетатов гидроксо- и дигидроксоалюминия:
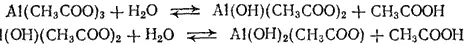
Рассмотрим для данного случая отдельно гидролиз катиона и гидролиз аниона. Эти процессы выражаются ионно-молекулярными уравнениями:

- 254 -
Итак, при гидролизе катиона образуются ионы H+, а при гидролизе аниона — ионы OH-. Эти ионы не могут в значительных концентрациях сосуществовать; они соединяются, образуя молекулы воды. Это приводит к смещению обоих равновесий вправо. Иначе говоря, гидролиз катиона и гидролиз аниона в этом случае усиливают друг друга.
Реакция растворов солей, образованных слабой кислотой и слабым основанием, зависит от соотношения констант диссоциации кислоты и основания, образующих соль. Если константа диссоциации кислоты больше константы диссоциации основания, то раствор имеет слабокислую реакцию, при обратном соотношении констант диссоциации — слабощелочную.
Если кислота и основание, образующие соль, не только слабые электролиты, но и малорастворимы или неустойчивы и разлагаются с образованием летучих продуктов, то гидролиз соли часто протекает необратимо, т. е. сопровождается полным разложением соли. Так, при взаимодействии в растворе соли алюминия, например AlCl 3, с карбонатом натрия выпадает осадок гидроксида алюминия и выделяется диоксид углерода
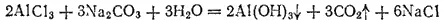
или
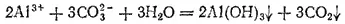
Интервал:
Закладка:








