Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
- 249 -
В обоих случаях процесс возможен и протекает потому, что связывание ионов H+ и OH- в молекулы воды происходит в большей степени, чем в молекулы Zn(OH) 2.
92. Гидролиз солей.
Гидролизом* называется взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды. Примером гидролиза может служить взаимодействие хлорида фосфора(III) PCl 3с водой. В результате этой реакции образуются фосфористая кислота H 3PO 3и соляная кислота:
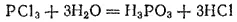
* Гидролиз в переводе означает "разложение водой"
Гидролизу подвержены соединения различных классов. В настоящем параграфе рассматривается один из важнейших его случаев — гидролиз солей.
Мы уже говорили, что в случае реакций нейтрализации, в которых участвуют слабые кислоты и основания, реакции протекают не до конца. Значит при этом в той или иной степени протекает и обратная реакция (взаимодействие соли с водой), приводящая к образованию кислоты и основания. Это и есть гидролиз соли.
В реакции гидролиза вступают соли, образованные слабой кислотой и слабым основанием, или слабой кислотой и сильным основанием, или слабым основанием и сильной кислотой. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются; нейтрализация в этом случае сводится к процессу
H ++ OH -= H 2O
а обратная реакция — диссоциация молекулы воды на ионы — протекает в ничтожно малой степени.
Рассмотрим гидролиз соли, образованной одноосновной кислотой и одновалентным металлом. В качестве примера возьмем ацетат натрия — соль слабой кислоты и сильного основания. Уравнение гидролиза этой соли имеет вид
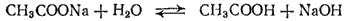
или в ионно-молекулярной форме:

Уравнение показывает, что в данном случае гидролизу подвергается анион соли и что реакция сопровождается образованием ионов OH-. Но поскольку ионное произведение воды [H+][OH-] — величина постоянная, то при накоплении ионов OH- концентрация ионов водорода уменьшается. Следовательно, растворы солей, образованных слабой кислотой и сильным основанием, имеют щелочную реакцию.
- 250 -
Аналогично в случае соли, образованной слабым основанием и сильной кислотой, гидролизу подвергается катион соли и реакция сопровождается образованием ионов H+, например

или
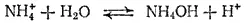
Накопление ионов H+ приводит к уменьшению концентрации ионов OH-. Таким образом, растворы солей, образованных слабым основанием и сильной кислотой, имеют кислую реакцию.
В рассмотренных случаях гидролизу подвергается не все количество находящейся в растворе соли, а только часть его. Иначе говоря, в растворе устанавливается равновесие между солью и образующими ее кислотой и основанием. Доля вещества, подвергающаяся гидролизу, — степень гидролиза — зависит от константы этого равновесия, а также от температуры и от концентрации соли.
Запишем уравнение гидролиза в общем виде. Пусть НА — кислота, МОН — основание, МА — образованная ими соль. Тогда уравнение гидролиза будет иметь вид:

Этому равновесию отвечает константа:
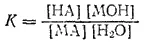
Концентрация воды в разбавленных растворах представляет собою практически постоянную величину. Обозначая
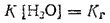
получим:
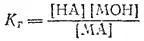
Величина K rназывается константой гидролиза соли. Ее значение характеризует способность данной соли подвергаться гидролизу; чем больше K r, тем в большей степени (при одинаковых температуре и концентрации соли) протекает гидролиз.
Для случая соли, образованной слабой кислотой и сильным основанием, константа гидролиза связана с константой диссоциации кислоты K кислзависимостью:
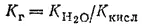
Это уравнение показывает, что K rтем больше, чем меньше K кисл. Иными словами, чем слабее кислота, тем в большей степени подвергаются гидролизу ее соли.
- 251 -
Для солей, образованных слабым основанием и сильной кислотой, аналогичное соотношение связывает константу гидролиза о константой диссоциации основания K осн:
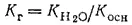
Поэтому, чем слабее основание, тем в большей степени подвергаются гидролизу образованные им соли.
Для солей, образованных слабой кислотой и слабым основанием, константа гидролиза связана с константами диссоциации кислоты и основания следующим соотношением:
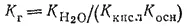
Соотношения, связывающие константу гидролиза с константами диссоциации кислоты и основания, легко получить из выражения константы гидролиза. Выведем первое из них, относящееся к случаю слабой кислоты и сильного основания. Для этого учтем, что основание МОН, от которого образована соль МА, — сильное, т. е. диссоциирует нацело. Поэтому
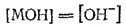
Сама соль также диссоциирует нацело. Следовательно:
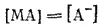
Концентрацию кислоты, пренебрегая диссоциированной ее частью, выразим через константу диссоциации кислоты K кисл:
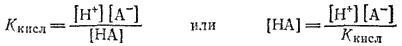
Подставляем найденные значения концентраций МОН, МА и НА в выражение константы гидролиза:
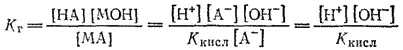
Учитывая, что [H+][OH-] ионное произведение воды, окончательно получим:
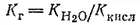
Степень гидролиза определяется природой соли, ее концентрацией и температурой. Природа соли проявляется в величине константы гидролиза. Зависимость от концентрации выражается в том, что с разбавлением раствора степень гидролиза увеличивается. В самом деле, пусть мы имеем, например, раствор цианида калия. В нем устанавливается равновесие
Читать дальшеИнтервал:
Закладка:








