Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Из этого, в частности, следует, что сильные кислоты вытесняют слабые из растворов их солей. Например, при взаимодействии ацетата натрия с соляной кислотой реакция практически нацело протекает с образованием уксусной кислоты
CH 3COONa + HCl = CH 3COOH + NaCl
или в ионно-молекулярной форме:
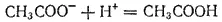
Аналогично протекают реакции между сильными основаниями и солями слабых основании. Например, при действии гидроксида натрия на сульфат железа(II) выделяется гидроксид железа(II)
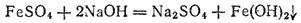
или в ионно-молекулярной форме:
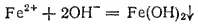
Последняя реакция служит примером образования не только слабого, но и малорастворимого электролита.
С рассмотренной точки зрения становится ясным различие между реакциями нейтрализации сильной кислоты сильным основанием и случаями нейтрализации, когда хотя бы одно из исходных веществ — слабый электролит. При нейтрализации сильной кислоты сильным основанием в растворе образуется только один слабый электролит — вода. При этом равновесие
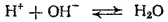
сильно смещено вправо и реакция в этом случае доходит практически до конца. При нейтрализации же слабой кислоты или слабого основания в растворе существуют, по крайней мере, два слабых электролита — вода и слабая кислота или слабое основание.
- 247 -
Например, при нейтрализации уксусной кислоты сильным основанием в растворе устанавливаются два равновесия:
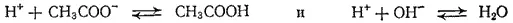
Ион водорода может, таким образом, связаться в молекулу уксусной кислоты или в молекулу воды. Ионы CH 3COO- и OH- как бы «конкурируют» друг с другом в связывании иона водорода. Поэтому в данном случае реакция нейтрализации доходит не до конца, а до состояния равновесия:

Однако это равновесие сильно смещено вправо, поскольку вода — значительно более слабый электролит, чем уксусная кислота, так что связывание ионов H+ в молекулы воды происходит полнее, чем в молекулы уксусной кислоты.
При нейтрализации слабого основания — гидроксида аммония — сильной кислотой в растворе тоже устанавливаются два равновесия:

Здесь конкурируют ионы NH 4 +и H +, связывающие гидроксид-ионы в недиссоциированные молекулы. В результате и эта реакция доходит не до конца, а до состояния равновесия:

Но поскольку вода — значительно более слабый электролит, чем NH 4OH, равновесие сильно смещено вправо.
Подобные процессы происходят и при реакциях, в ходе которых малорастворимое вещество превращается в растворимый, но слабо диссоциирующий продукт. К таким реакциям относится, например, растворение сульфидов некоторых металлов в соляной кислоте. Так, взаимодействие сульфида марганца с соляной кислотой выражается уравнением
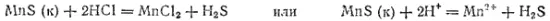
Присутствие в числе исходных веществ малорастворимого электролита (MnS), при образовании которого связываются ионы S 2-, обусловливает протекание реакции влево. С другой стороны, при образовании слабого электролита (H 2S) также связываются ионы S 2-, что способствует протеканию реакции вправо. Таким образом, ионы S 2-участвуют в двух конкурирующих процессах, приводящих к установлению двух равновесий:

Направление рассматриваемой реакции зависит от того, какое из двух веществ — H 2S или MnS — в большей степени связывает ионы S 2-.
- 248 -
Суммарная константа диссоциации сероводорода K=K 1K 2=6·10 -22(см. табл. 12); произведение же растворимости MnS равно 2.5·10 -10(см. табл. 16). Отсюда ясно, что связывание ионов S 2-в молекулы сероводорода происходит полнее, чем в MnS. Поэтому рассматриваемая реакция протекает вправо — сульфид марганца растворяется в соляной кислоте.
Аналогичные два равновесия устанавливаются в системе соляная кислота — сульфид меди(II). Но произведение растворимости CuS очень мало, оно равно 6·10 -36(см. табл. 16). Поэтому связывание ионов S 2-в CuS происходит полнее, чем в молекулы сероводорода, и равновесие в системе
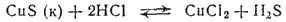
смещено влево; сульфид меди(II) нерастворим в соляной кислоте.
Рассмотренные закономерности позволяют понять поведение амфотерных гидроксидов. Так, равновесие между осадком гидроксида цинка и раствором нарушается при добавлении как кислоты, так и щелочи. В этом случае равновесие можно записать в форме:
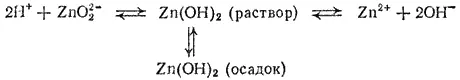
При добавлении к гидроксиду цинка кислоты возрастает концентрация ионов водорода. Произведение [H+][OH-] становится больше ионного произведения воды — идет процесс образования молекул H 2O из ионов; при этом нарушается равновесие и в системе Zn(OH) 2. Согласно принципу Ле Шателье, вследствие возрастания концентрации ионов H+ и расхода ионов OH-, диссоциация Zn(OH 2) по типу кислоты подавляется, а по типу основания усиливается. В итоге осадок Zn(OH) 2растворяется и образуется соль, в которой цинк является катионом. Например, в случае соляной кислоты пойдет реакция:
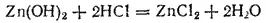
При добавлении к гидроксиду цинка щелочи возрастает концентрация ионов OH-: в этом случае процесс идет в направлении связывания ионов водорода. Равновесие в системе нарушается, но теперь преобладает диссоциация Zn(OH) 2по типу кислоты. В итоге осадок Zn(OH) 2растворяется и образуется соль, в которой цинк входит в состав аниона. Например, при добавлении NaOH идет реакция:
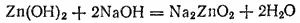
Интервал:
Закладка:








