Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Кислые соли слабых кислот также подвергаются гидролизу. Однако здесь наряду с гидролизом происходит и диссоциация аниона кислой соли. Так, в растворе гидрокарбоната натрия одновременно протекают гидролиз иона HCOJ, приводящий к накоплению ионов OH-
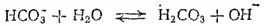
и диссоциация иона HCO 3-, в результате которой образуются ионы H+:
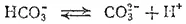
Таким образом, реакция раствора кислой соли может быть как щелочной (если гидролиз аниона преобладает над его диссоциацией), так и кислой (в обратном случае). Это определяется соотношением константы гидролиза соли и соответствующей константы диссоциации кислоты. В рассмотренном примере константа гидролиза аниона превышает соответствующую константу диссоциации кислоты, поэтому раствор имеет слабо щелочную реакцию. При обратном соотношении (например, при гидролизе NaHSO 3) реакция раствора кислая.
Протонная теория кислот и оснований рассматривает гидролиз как частный случай кислотно-основного равновесия: протон переходит от молекулы воды к данному иону или от данного иона к молекуле воды.
- 255 -
Например, гидролиз иона аммония можно выразить уравнением:
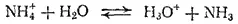
Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
93. Окисленность элементов.
Когда элемент находится в свободном состоянии — образует простое вещество, тогда движение электронов около всех атомов этого вещества происходит одинаково. Это справедливо для всех простых веществ, независимо от их структуры. Например, в молекуле водорода электроны в равной мере движутся около обоих атомов: молекула H 2неполярна. В случае кристаллов с ковалентной связью химические связи между атомами также симметричны относительно связуемых атомов. В случае металлов распределение как связанных, так и свободных электронов в среднем также является равномерным.
Иначе обстоит дело в сложных веществах. Химические связи между атомами различных элементов несимметричны; в молекулах сложных веществ осуществляются, как правило, полярные ковалентные связи. В ионных соединениях эта неравномерность распределения электронов максимальна — при образовании веществ с ионной связью валентные электроны практически полностью переходят от атома одного элемента к атому другого.
Неравномерность распределения электронов между атомами в соединениях получила название окислен пост и. При этом элемент, электроны которого смещаются к атомам другого элемента (полностью в случае ионной связи или частично в случае полярной), проявляет положительную окисленность. Элемент, к атомам которого смещаются электроны атома другого элемента, проявляет отрицательную окисленность.
Число электронов, смещенных от одного атома данного элемента (при положительной окисленности) или к одному атому данного элемента (при отрицательной окисленности), называется степенью окисленности элемента.
В простых веществах степень окисленности элемента всегда равна нулю. В соединениях некоторые элементы проявляют всегда одну и ту же степень окисленности, но для большинства элементов она в различных соединениях различна.
Постоянную степень окисленности имеют щелочные металлы (+1) щелочноземельные металлы (+2), фтор (-1). Для водорода в большинстве соединений характерна степень окисленности +1 а в гидридах металлов (§ 116) некоторых других соединениях она равна —1.
- 256 -
Степень окисленности кислорода, как правило, равна —2; к важнейшим исключениям относятся пероксидные соединения, где она равна —1, и фторид кислорода OF 2, в котором степень окисленности кислорода равна +2. Для элементов с непостоянной степенью окисленности ее значение всегда нетрудно подсчитать, зная формулу соединения и учитывая, что сумма степеней окисленности всех атомов в молекуле равна нулю.
Определим в качестве примера степень окисленности углерода в СО, CO 2, CH 4, C 2H 6, C 2H 5OH. Обозначим ее через x. Тогда, помня, что степень окисленности водорода равна +1, а кислорода —2, получим:
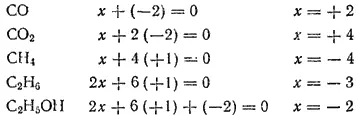
Для установления степени окисленности элементов в соединениях можно пользоваться таблицей электроотрицательностей элементов (табл. 6). При этом следует иметь в виду, что при образовании химической связи электроны смещаются к атому более электроотрицательного элемента. Так, относительная электроотрицательность фосфора равна 2,2, а иода 2,6. Поэтому в соединении PI 3общие электроны смещены к атомам иода и степени окисленности фосфора и иода равны соответственно +3 и -1. Однако в нитриде иода NI 3степени окисленности азота и иода равны —3 и +1, поскольку электроотрицательность азота (3,07) выше электроотрицательности иода.
94. Окислительно-восстановительные реакции.
Все химические реакции можно разбить на две группы. В реакциях первой группы окисленность всех элементов, входящих в состав реагирующих веществ, остается неизменной, а в реакциях второй группы окисленность одного или нескольких элементов изменяется.
В качестве примера реакций первой группы можно привести реакцию нейтрализации:
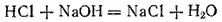
Примером реакции второй группы может служить взаимодействие металла с кислотой:
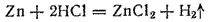
Если при реакции нейтрализации ни один элемент не изменяет степень своей окисленности, то во втором примере степень окисленности цинка изменяется от 0 до +2, а водорода — от +1 до 0.
Реакции, в результате которых изменяются степени окисленности элементов, называются окислительно-восстановительными.
- 257 -
Окислительно-восстановительные реакции имеют очень большое значение в биологических системах. Фотосинтез, дыхание, пищеварение — все это цепи окислительно-восстановительных реакций. В технике значение окислительно-восстановительных реакций также очень велико. Так, вся металлургическая промышленность основана на окислительно-восстановительных процессах В ходе которых металлы выделяются из природных соединений.
Простым примером окислительно-восстановительной реакции может служить реакция образования ионного соединения из простых веществ, например, взаимодействие натрия с хлором:
Читать дальшеИнтервал:
Закладка:








