Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Эта полуреакция протекает (в сторону восстановления) при взаимодействии перманганата калия с большинством восстановителей в кислой среде.
Концентрации всех веществ, участвующих в рассматриваемом электродном процессе, кроме воды, — величины переменные. Для этого процесса ℰ° =1.507 B. Уравнение электродного потенциала имеет вид:
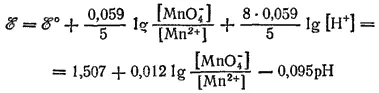
Примеры 3 и 4 показывают, что в случае электрохимических процессов, протекающих с участием воды, концентрация ионов водорода входит в числитель логарифмического члена уравнения потенциала. Поэтому электродные потенциалы таких процессов зависят от pH раствора и имеют тем большую величину, чем кислее раствор.
- 277 -
Таблица 18. Электродные потенциалы в водных растворах при 25°C и при парциальном давлении газов, равном нормальному атмосферному давлению
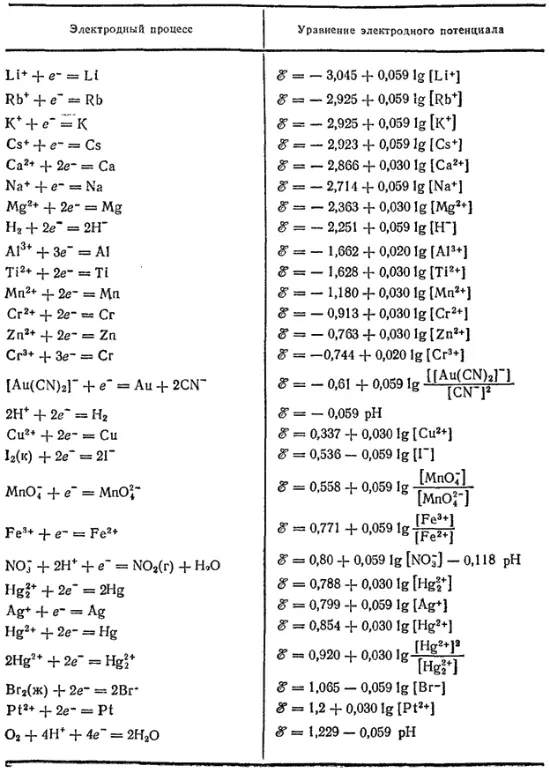
- 278 -
Продолжение табл. 18

Как уже сказано, зависимость электродного потенциала от природы веществ — участников электродного процесса учитывается величиной ℰ°. В связи с этим все электродные процессы принято располагать в ряд по величине их стандартных потенциалов. В табл. 18 уравнения важнейших электродных процессов и соответствующие электродные потенциалы приведены в порядке возрастания величин ℰ°.
Положение той или иной электрохимической системы в этом ряду характеризует ее окислительно-восстановительную способность. Под электрохимической системой здесь подразумевается совокупность всех веществ — участников данного электродного процесса.
Окислительно-восстановительная способность представляет собою понятие, характеризующее именно электрохимическую систему, но часто говорят и об окислительно-восстановительной способности того или иного вещества (или иона). При этом следует, однако, иметь в виду, что многие вещества могут окисляться или восстанавливаться до различных продуктов. Например, перманганат калия (ион MnO 4 -) может в зависимости от условий, прежде всего от pH раствора, восстанавливаться либо до иона Mn 2+, либо до MnO 2, либо до иона MnO 4 -
Соответствующие электродные процессы выражаются уравнениями:
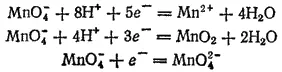
- 279 -
Поскольку стандартные потенциалы этих трех электродных процессов различны (см. табл. 18), то различно и положение этих трех систем в ряду Таким образом, один и тот же окислитель (MnO 4 -) может занимать в ряду стандартных потенциалов несколько мест.
Элементы, проявляющие в своих соединениях только одну степень окисленности, имеют простые окислительно-восстановительные характеристики и занимают в ряду стандартных потенциалов мало мест. К их числу относятся в основном металлы главных подгрупп I—III групп периодической системы. Много же мест в ряду занимают те элементы, которые образуют соединения различных степеней окисленности — неметаллы и многие металлы побочных подгрупп периодической системы.
Ряд стандартных электродных потенциалов позволяет решать вопрос о направлении самопроизвольного протекания окислительно-восстановительных реакций. Как и в общем случае любой химической реакции, определяющим фактором служит здесь знак изменения энергии Гиббса реакции. Если из двух электрохимических систем составить гальванический элемент, то при его работе электроны будут самопроизвольно переходить от отрицательного полюса элемента к положительному, т. е. от электрохимической системы с более низким значением электродного потенциала к системе с более высоким его значением. Но это означает, что первая из этих систем будет выступать в качестве восстановителя, а вторая— в качестве окислителя. Следовательно, в гальваническом элементе окислительно-восстановительная реакция может самопроизвольно протекать в таком направлении, при котором электрохимическая система с более высоким значением электродного потенциала выступает в качестве окислителя, т. е. восстанавливается. При непосредственном взаимодействии веществ возможное направление реакции будет, конечно, таким же, как и при ее осуществлении в гальваническом элементе.
Если окислитель и восстановитель расположены далеко друг от друга в ряду ℰ°, то направление реакции практически полностью определяется их взаимным положением в этом ряду. Например, цинк (ℰ°=-0.763 B) будет вытеснять медь (ℰ°=+0.337 B) из водного раствора ее соли при любой практически осуществимой концентрации этого раствора. Если же величины ℰ° для окислителя и восстановителя близки друг к другу, то при решении вопроса о направлении самопроизвольного протекания реакции необходимо учитывать влияние на электродные потенциалы также и концентраций соответствующих веществ. Например, реакция
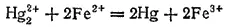
может самопроизвольно идти как слева направо, так и справа налево. Направление ее протекания определяется концентрациями ионов железа и ртути. В этой реакции участвуют две электрохимические системы:
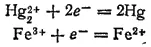
- 280 -
Соответствующим электродным процессам отвечают потенциалы:
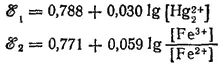
Подсчитаем величины ℰ° 1и ℰ° 2при [Hg 2 2+] = [Fe 2+] = 10 -1и [Fe 3+] = 10 -4моль/1000 г. H 2O:
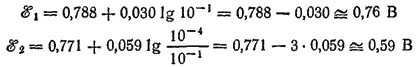
Таким образом, при взятом соотношении концентраций ℰ° 1> ℰ° 2и реакция протекает слева направо.
Теперь подсчитаем ℰ° 1и ℰ° 2при обратном соотношении концентраций. Пусть [Hg 2 2+] = [Fe 2+] = 10 -4, а [Fe 3+] = 10 -4моль/1000 г. H 2O
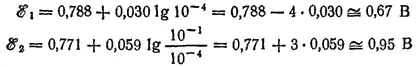
Следовательно, при этих концентрациях ℰ° 1> ℰ° 2и реакция протекает справа налево.
Если окислительно-восстановительная реакция протекает с участием воды и ионов водорода или гидроксид-ионов, то необходимо учитывать также величину pH среды.
В табл. 18 включено 39 полуреакций; комбинируя их друг с другом, можно решить вопрос о направлении самопроизвольного протекания 39·38/2=741 реакции.
Пример. Установить, направление возможного протекания реакции:
Читать дальшеИнтервал:
Закладка:








