Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Оксид хрома(III) Cr 2O 3представляет собой тугоплавкое вещество зеленого цвета, применяемое род названием зеленого крона для приготовления клеевой и масляной красок. При сплавлении с силикатами оксид хрома (III) окрашивает их в зеленый цвет и поэтому служит для окраски стекла и фарфора, Cr 2O 3входит также в состав полирующих средств.
Гидроксид хрома(III) Cr(OH) 3выпадает в виде синевато-серого осадка при действии щелочей на соли хрома(III):
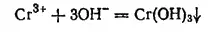
Подобно гидроксидам алюминия и цинка, он имеет амфотерный характер и растворяется в кислотах с образованием солей хрома (III), а в щелочах — с образованием изумрудно-зеленых растворов хромитов, например:
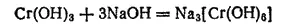
или
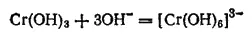
Хромиты, полученные сплавлением Cr 2O 3с оксидами других металлов и известные главным образом для двухвалентных металлов, имеют состав, отвечающий формуле M(CrO 2) 2, и представляют собой соли метахромистой кислоты HCrO 2.
- 635 -
К ним относится и природный хромистый железняк Fe(CrO 2O) 2.
Из солей хрома(III) самой распространенной является двойная соль хрома и калия — хромокалиевые квасцы KCr(SO 4) 2·12H 2O, образующие сине-фиолетовые кристаллы. Хромокалиевые квасцы применяются в кожевенной промышленности для дубления кож и в текстильной промышленности в качестве протравы при крашении.
Соли хрома(III) во многом похожи на соли алюминия. В водных растворах они сильно гидролизованы и легко превращаются в основные соли. Со слабыми кислотами хром(III), подобно алюминию, солей не образует.
Растворы солей хрома (III) обычно имеют сине-фиолетовый цвет, но при нагревании становятся зелеными, а спустя некоторое время после охлаждения снова приобретают прежнюю окраску. Это изменение окраски объясняется образованием изомерных гидратов солей, представляющих собой комплексные соединения, в которых все или часть молекул воды координационно связаны во внутренней сфере комплекса. В некоторых случаях такие гидраты удалось выделить в твердом виде. Так, кристаллогидрат хлорида хрома (III) CrCl 3·6H 2O известен в трех изомерных формах: в виде сине-фиолетовых, темнозеленых и светло-зеленых кристаллов одинакового состава. Строение этих изомеров можно установить на основании различного отношения их свежеприготовленных растворов к нитрату серебра. При действии последнего на раствор сине-фиолетового гидрата осаждается весь хлор; из раствора темнозеленого гидрата осаждается 2/3 хлора, а из раствора светло-зеленого гидрата — только 1/3 хлора. Принимая во внимание эти данные, а также координационное число хрома, равное шести, строение рассматриваемых кристаллогидратов можно выразить следующими формулами:
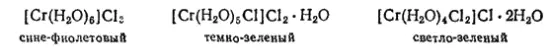
сине-фиолетовый темно-зеленый светло-зеленый
Таким образом, изомерия гидратов хлорида хрома (III) обусловлена различным распределением одних и тех же групп (H 2O и Cl-) между внутренней и внешней координационными сферами и может служить примером гидратной изомерии (стр. 574).
Важнейшими соединениями хрома (VI) являются триоксид хрома, или хромовый ангидрид, CrO 3и соли отвечающих ему кислот — хромовой H 2CrO 4и двухромовой H 2Cr 2O 7. Обе кислоты существуют только в водном растворе и при попытках выделить их из раствора распадаются на хромовый ангидрид и воду; но соли их достаточно стойки. Соли хромовой кислоты называются хроматами, а двухромовой — бихроматами или дихроматами.
Почти все хроматы имеют желтую окраску. Некоторые из них применяются в качестве красок. Например, нерастворимый в воде хромат свинца PbCrO 4, под названием желтый крон, служит для приготовления желтой масляной краски.
При подкислении раствора какого-нибудь хромата, например хромата калия K 2CrO 4, чисто-желтая окраска раствора сменяется на оранжевую вследствие перехода ионов CrO 4 2-в ионы Cr 2O 7 2-.
- 636 -
Из полученного раствора может быть выделена соль двухромовой кислоты — дихромат калия K 2Cr 2O 7— в виде оранжево-красных кристаллов. Реакция превращения хромата в дихромат выражается уравнением:

Реакция обратима. Это значит, что при растворении дихромата в воде всегда образуется некоторое, хотя и незначительное, количество ионов H+ и CrO 4 2-поэтому раствор дихромата имеет кислую реакцию. Если к раствору дихромата прибавлять щелочь, то гидроксид-ионы будут связывать находящиеся в растворе ионы водорода, равновесие смещается влево и в результате дихромат превращается в хромат. Таким образом, в присутствии избытка гидроксид-ионов в растворе практически существуют только ионы CrO 4 2-, т. е. хромат, а при избытке ионов водорода — ионы Cr 2O 7 2-, т. е. дихромат.
Хроматы щелочных металлов получаются путем окисления соединений хрома(III) в присутствии щелочи. Так, при действии брома на раствор хромита калия образуется хромат калия:
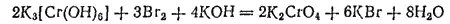
О происходящем окислении можно судить по тому, что изумрудно-зеленая окраска раствора хромита переходит в ярко-желтую.
Хроматы могут быть получены также сплавлением Cr 2O 3со щелочью в присутствии какого-нибудь окислителя, например хлората калия:
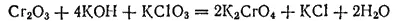
Хроматы и дихроматы — сильные окислители. Поэтому ими широко пользуются для окисления различных веществ. Окисление производится в кислом растворе и обычно сопровождается резким изменением окраски (дихроматы окрашены в оранжевый цвет, а соли хрома(III) зеленый или зеленовато-фиолетовый).
Мы видели, что в кислых и в щелочных растворах соединения хрома (III) и хрома (VI) существуют в разных формах: в кислой среде в виде ионов Cr 3+или Cr 2O 7 2-, а в щелочной — в виде ионов [Cr(OH) 6] 3-или CrO 4 2-. Поэтому взаимопревращение соединений хрома (III) и хрома (VI) протекает по-разному в зависимости от реакции раствора. В кислой среде устанавливается равновесие
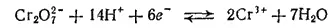
Интервал:
Закладка:








