Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
- 642 -
Технеций был первым элементом, полученным искусственным, «техническим» путем, что и послужило основанием для его названия.
231. Марганец (Manganum).
Марганец принадлежит к довольно распространенным элементам, составляя 0.1% (масс.) земной коры. Из соединений, содержащих марганец, наиболее часто встречается минерал пиролюзит, представляющий собой диоксид марганца MnO 2. Большое значение имеют также минералы гаусманит Mn 3O 4и браунит Mn 2O 3.
СССР располагает большими запасами марганца. По запасам руд с высоким содержанием марганца СССР занимает первое место в мире.
Марганец получают либо электролизом раствора MnSO 4, либо восстановлением из его оксидов кремнием в электрических печах. Второй (силикотермический) метод более экономичен, но дает менее чистый продукт. При электролитическом методе руду восстанавливают до соединений марганца со степенью окисленности +2, а затем растворяют в смеси серной кислоты с сульфатом аммония. Получающийся раствор подвергают электролизу. Снятые с катодов осадки металла переплавляют в слитки.
Марганец — серебристо-белый твердый хрупкий металл. Его плотность 7,44 г/см 3, температура плавления 1245°C. Известны четыре кристаллические модификации марганца, каждая из которых термодинамически устойчива в определенном интервале температур. Ниже 707°C устойчив а-марганец, имеющий сложную структуру — в его элементарную ячейку входят 58 атомов. Сложность структуры марганца при температурах ниже 707°C обусловливает его хрупкость.
В ряду напряжений марганец находится между алюминием и цинком: стандартный электродный потенциал системы Mn 2+/Mn равен —1,18 В. На воздухе марганец покрывается тонкой оксидной пленкой, предохраняющей его от дальнейшего окисления даже при нагревании. Но в мелкораздробленном состоянии марганец окисляется довольно легко. Вода при комнатной температуре действует на марганец очень медленно, при нагревании — быстрее. Он растворяется в разбавленных соляной и азотной кислотах, а также в горячей концентрированной серной кислоте (в холодной H 2SO 4он практически нерастворим); при этом образуются катионы Mn 2+.
Марганец применяется главным образом в производстве легированных сталей. Марганцовистая сталь, содержащая до 15% Mn, обладает высокими твердостью и прочностью. Из нее изготовляют рабочие части дробильных машин, шаровых мельниц, железнодорожные рельсы. Кроме того, марганец входит в состав ряда сплавов на основе магния; он повышает их стойкость против коррозии. Сплав меди с марганцем и никелем — манганин (см. § 200) дает низким температурным коэффициентом электрического сопротивления.
- 643 -
В небольших количествах марганец вводится во многие сплавы алюминия.
Марганец образует четыре простых оксида (MnO, Mn 2O 3, MnO 2и Mn 2O 7) и смешанный оксид Mn 3O 4(или MnO·Mn 2O 3). Первые два оксида обладают основными свойствами, диоксид марганца MnO 2амфотерен, а высший оксид Mn 2O 7является ангидридом марганцовой кислоты HMnO 4. Известны также производные марганца (IV), но соответствующий оксид MnO 3не получен.
В практическом отношении наиболее важны соединения марганца (II), диоксид марганца и соли марганцовой кислоты—перманганаты, в которых марганец находится в степени окисленности +7.
Соли марганца (II) получаются при растворении марганца в разбавленных кислотах или при действии кислот на различные природные соединения марганца. Так, из раствора, остающегося после получения хлора действием соляной кислоты на диоксид марганца, выкристаллизовывается хлорид марганца(II) MnCl 2в виде бледно-розовых кристаллов. В твердом виде соли марганца (II) обычно розового цвета, растворы же их почти бесцветны.
При действии щелочей на растворы солей марганца(II) выпадает белый осадок — гидроксид марганца(II) Mn(OH) 2. Осадок легко растворяется в кислотах. На воздухе он быстро темнеет, окисляясь в бурый гидроксид марганца(IV) Mn(OH) 4.
Оксид марганца(II), или закись марганца, MnO получается в виде зеленого порошка при восстановлении других оксидов марганца водородом.
Наиболее стойким соединением марганца является темно-бурый диоксид марганца MnO 2; он легко образуется как при окислении низших, так и при восстановлении высших соединений марганца. Как уже указывалось, MnO 2— амфотерный оксид; однако и кислотные, и основные свойства выражены у него очень слабо.
В кислой среде диоксид марганца — довольно энергичный окислитель. В качестве окислителя его применяют при получении хлора из соляной кислоты и в сухих гальванических элементах. Соли марганца (IV), например MnCl 4и Mn(SO 4) 2, весьма нестойки.
При сплавлении диоксида марганца с карбонатом и нитратом калия получается зеленый сплав, растворяющийся в воде с образованием красивого зеленого раствора. Из этого раствора можно выделить темно-зеленые кристаллы манганита калия K 2MnO 4- соли марганцовистой кислоты H 2MnO 4, очень нестойкой даже в растворе.
Реакцию образования манганата калия можно выразить уравнением:
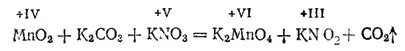
- 644 -
Если раствор манганата оставить стоять на воздухе, то окраска его постепенно изменяется, переходя из зеленой в малиновую, причем образуется темно-бурый осадок. Это объясняется тем, что в водном растворе манганаты самопроизвольно превращаются в соли марганцовой кислоты HMnO 4(перманганаты) с одновременным образованием диоксида марганца. Реакция выражается уравнением
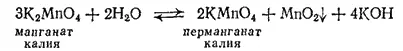
или в ионно-молекулярной форме:
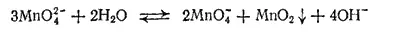
При этой реакции один ион MnO 4 2-окисляет два других таких же иона в ионы MnO 4 -, а сам восстанавливается, образуя MnO 2.
Процесс превращения манганата в перманганат обратим. Поэтому в присутствии избытка гидроксид-ионов зеленый раствор манганата долгое время может сохраняться без изменения. Если же прибавить кислоту, связывающую гидроксид-ионы, зеленая окраска почти мгновенно изменяется на малиновую.
При действии сильных окислителей (например, хлора) на раствор манганата последний полностью превращается в перманганат:
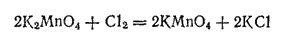
Перманганат калия KMnO 4— наиболее широко применяемая соль марганцовой кислоты. Кристаллизуется он в виде красивых темно-фиолетовых, почти черных призм, умеренно растворимых в воде. Растворы KMnO 4имеют темно-малиновый, а при больших концентрациях — фиолетовый цвет, свойственный ионам MnO 4 -. Как и все соединения марганца (VII), перманганат калия — сильный окислитель. Он легко окисляет многие органические вещества, превращает соли железа (II) в соли железа (III), сернистую кислоту окисляет в серную, из соляной кислоты выделяет хлор и т. д.
Читать дальшеИнтервал:
Закладка:








