Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:

Рис 7. К понятию об орбитальном моменте количества движения.
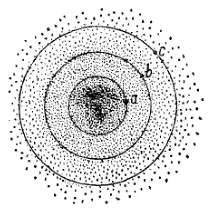
Рис. 8. К понятию о размерах и форме электронного облака
Мы уже знаем, что энергия электрона в атоме зависит от главного квантового числа n. В атоме водорода энергия электрона полностью определяется значением n.
- 75 -
Однако в многоэлектронных атомах энергия электрона зависит и от значения орбитального квантового числа l; причины этой зависимости будут рассмотрены в § 31. Поэтому состояния электрона, характеризующиеся различными значениями l, принято называть энергетическими подуровнямиэлектрона в атоме. Этим подуровням присвоены следующие буквенные обозначения:
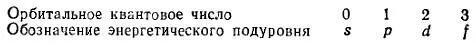
В соответствии с этими обозначениями говорят об s-подуровне, p-подуровне и т.д. Электроны, характеризующиеся значениями побочного квантового числа 0, 1, 2 и 3, называют соответственно s-электронами, p-электронами, d-электронами и f-электронами. При данном значении главного квантового числа n наименьшей энергией обладают s-электроны, затем p-, d- и f- электроны.
Состояние электрона в атоме, отвечающее определенным значениям n и l, записывается следующим образом: сначала цифрой указывается значение главного квантового числа, затем буквой — орбитального квантового числа. Так, обозначение 2p относится к электрону, у которого n=2 и l=1, обозначение 3d к электрону, у которого n=3 и l=2.
Электронное облако не имеет резко очерченных в пространстве границ. Поэтому понятие о его размерах и форме требует уточнения. Рассмотрим в качестве примера электронное облако 1s-электрона в атоме водорода (рис. 8). В точке а, находящейся на некотором расстоянии от ядра, плотность электронного облака определяется квадратом волновой функции ψ a 2. Проведем через точку а поверхность равной электронной плотности, соединяющую точки в которых плотность электронного облака характеризуется тем же значением ψ a 2. В случае 1s-электрона такая поверхность окажется сферой, внутри которой заключена некоторая часть электронного облака (на рис. 8 сечение этой сферы плоскостью рисунка изображено окружностью, проходящей через точку а). Выберем теперь точку b, находящуюся на б'ольшем расстоянии от ядра, и также проведем через нее поверхность равной электронной плотности. Эта поверхность тоже будет обладать сферической формой, но внутри ее будет заключена б'ольшая часть электронного облака, чем внутри сферы а. Пусть, наконец, внутри поверхности равной электронной плотности, проведенной через некоторую точку с, заключена преобладающая часть электронного облака; обычно эту поверхность проводят так, чтобы она заключала 90% заряда и массы электрона. Такая поверхность называется граничной поверхностью, и именно ее форму и размеры принято считать формой и размерами электронного облака. Граничная поверхность 1s-электрона представляет собой сферу, однако граничные поверхности p- и d-электронов имеют более сложную форму (см. ниже).
- 76 -
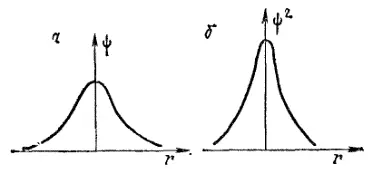
Рис. 9. Графики функции ψ и ψ 2для 1s-электрона.

Рис. 10. Электронное облако 1s-электрона.
На рис. 9 изображены значения волновой функции ψ (рис. 9, а) и ее квадрата (рис. 9, б) для 1s-электрона в зависимости от расстояния от ядра r. Изображенные кривые не зависят от направления, в котором откладывается измеряемое расстояние r; это означает, что электронное облако 1s- электрона обладает сферической симметрией, т.е. имеет форму шара. Кривая на рис. 9, а расположена по одну сторону от оси расстояний (ось абсцисс). Отсюда следует, что волновая функция 1s-электрона обладает постоянным знаком; будем считать его положительным.
Рис. 9, б показывает также, что при увеличении расстояния от ядра величина ψ 2монотонно убывает. Это означает, что по мере удаления от ядра плотность электронного облака 1s-электрона уменьшается; иллюстрацией этого вывода может служить рис. 5.
Это не означает, однако, что с ростом r вероятность обнаружить 1s-электрон тоже монотонно убывает. На рис. 10 выделен тонкий слой, заключенный между сферами с радиусами r и (r + Δr), где Δr — некоторая малая величина. С ростом r плотность электронного облака в рассматриваемом сферическом слое уменьшается; но одновременно возрастает объем этого слоя, равный 4π r 2Δr. Как указывалось в § 26, вероятность обнаружить электрон в малом объеме ΔV выражается произведением ψ 2ΔV. В данном случае ΔV = 4π r 2Δr; следовательно, вероятность обнаружения электрона в сферическом слое, заключенном между r и (r + Δr), пропорциональна величине 4π r 2ψ 2, В этом произведении с увеличением r множитель 4π r 2возрастает, а множитель ψ 2убывает. При малых значениях r величина 4π r 2возрастает быстрее, чем убывает ψ 2, при больших наоборот. Поэтому произведение 4π r 2ψ 2, характеризующее вероятность обнаружения электрона на расстоянии r от ядра, с увеличением r проходит через максимум.
Зависимость величины 4π r 2ψ 2от r изображена для 1s-электрона на рис. 11 (подобные графики называются графиками радиального распределения вероятностинахождения электрона). Как показывает рис. 11, вероятность обнаружить 1s-электрон на малых расстояниях от ядра близка к нулю, так как r мало. Ничтожно мала и вероятность обнаружения электрона на очень большом расстоянии от ядра: здесь близок к нулю множитель (см. рис. 9, б).
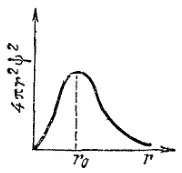
Рис. 11 График радиального распределения вероятности для 1s-электрона.
- 77 -
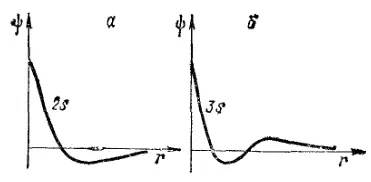
Рис. 12. Графики волновой функции для 2s-(а) и 3s-электронов (б).
На некотором расстоянии от ядра r 0вероятность обнаружения электрона имеет максимальное значение. Для атома водорода это расстояние равно 0,053 нм, что совпадает с вычисленным Бором значением радиуса ближайшей к ядру орбиты электрона. Однако трактовка этой величины в теории Бора и с точки зрения квантовой механики различна: согласно Бору, электрон в атоме водорода находится на расстоянии 0,053 нм от ядра, а с позиций квантовой механики этому расстоянию соответствует лишь максимальная вероятность обнаружения электрона.
Читать дальшеИнтервал:
Закладка:








