Николай Глинка - Общая химия
- Название:Общая химия
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:неизвестен
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Николай Глинка - Общая химия краткое содержание
Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы.
Легендарный учебник, переведенный на многие языки стран Европы, Азии, Африки и выпущенный общим тиражом свыше 5 миллионов экземпляров.
При изготовлении файла, использован сайт http://alnam.ru/book_chem.php
Общая химия - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Полярность молекул оказывает заметное влияние на свойства образуемых ими веществ. Полярные молекулы стремятся ориентироваться по отношению друг к другу разноименно заряженными концами. Следствием такого диполь-дипольного взаимодействия является взаимное притяжение полярных молекул и упрочнение связи между ними. Поэтому вещества, образованные полярными молекулами, обладают, как правило, более высокими температурами плавления и кипения, чем вещества, молекулы которых неполярны.
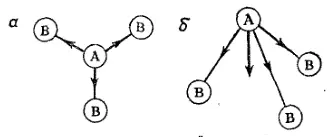
Рис. 31. Дипольные моменты отдельных связей в молекулах типа АВ 3:
а — плоский треугольник; б — пирамида; жирной стрелкой показан вектор суммарного дипольного момента молекулы.
При растворении вещества, состоящего из полярных молекул или имеющих ионное строение, в жидкости, также составленной из полярных молекул, между молекулярными диполями растворителя и молекулами или кристаллами растворяемого вещества возникают электростатические силы диполь-дипольного или ион-дипольного взаимодействия, способствующие распаду растворяемого вещества на ионы (см. § 83). Поэтому жидкости, состоящие из полярных молекул, проявляют свойства ионизирующих растворителей, т.е. способствуют электролитической диссоциации растворенных в них веществ.
- 122 -
Так, хлороводород растворяется и в воде, и в бензоле, но его растворы в воде хорошо проводят электрический ток, что свидетельствует о практически полной диссоциации молекул HCl на ионы, тогда как растворы HCl в бензоле не обладают заметной электрической проводимостью.
41. Способы образования ковалентной связи.
Как уже говорилось, общая электронная пара, осуществляющая ковалентную связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденных взаимодействующих атомах. Это происходит, например, при образовании таких молекул, как H 2, HCl, Cl 2. Здесь каждый из атомов обладает одним неспаренным электроном; при взаимодействии двух таких атомов создается общая электронная пара — возникает ковалентная связь.
В невозбужденном атоме азота имеются три неспаренных электрона:
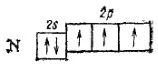
Следовательно, за счет неспаренных электронов атом азота может участвовать в образовании трех ковалентных связей. Это и происходит, например, в молекулах N 2или NH 3, в которых ковалентность азота равна 3.
Однако число ковалентных связей может быть и больше числа имеющихся у невозбужденного атома неспаренных электронов. Так, в нормальном состоянии внешний электронный слой атома углерода имеет структуру, которая изображается схемой:
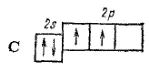
За счет имеющихся неспаренных электронов атом углерода может образовать две ковалентные связи. Между тем для углерода характерны соединения, в которых каждый его атом связан с соседними атомами четырьмя ковалентными связями (например, CO 2, CH 4и т.д.). Это оказывается возможным благодаря тому, что при затрате некоторой энергии можно один из имеющихся в атоме 2s-электронов перевести на подуровень 2p; в результате атом переходит в возбужденное состояние, а число неспаренных электронов возрастает. Такой процесс возбуждения, сопровождающийся «распариванием» электронов, может быть представлен следующей схемой, в которой возбужденное состояние отмечено звездочкой у символа элемента:
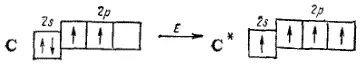
- 123 -
Теперь во внешнем электронном слое атома углерода находятся четыре неспаренных электрона; следовательно, возбужденный атом углерода может участвовать в образовании четырех ковалентных связей. При этом увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на перевод атома в возбужденное состояние.
Если возбуждение атома, приводящее к увеличению числа неспаренных электронов. Связано с очень большими затратами энергии, то эти затраты не компенсируются энергией образования новых связей% тогда такой процесс в целом оказывается энергетически невыгодным. Так, атомы кислорода и фтора не имеют свободных орбиталей во внешнем электронном слое:
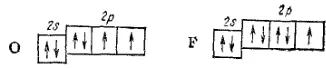
Здесь возрастание числа неспаренных электронов возможно только путем перевода одного из электронов на следующий энергетический уровень, т.е. в состояние 3s. Однако такой переход сопряжен с очень большой затратой энергии, которая не покрывается энергией, выделяющейся при возникновении новых связей. Поэтому за счет неспаренных электронов атом кислорода может образовать не больше двух ковалентных связей, а атом фтора — только одну. Действительно, для этих элементов характерна постоянная ковалентность, равная двум для кислорода и единице — для фтора.
Атомы элементов третьего и последующих периодов имеют во внешнем электронном слое d-подуровень, на которых при возбуждении могут переходить s- и p-электроны внешнего слоя. Поэтому здесь появляются дополнительные возможности увеличения числа неспаренных электронов. Так, атом хлора, обладающий в невозбужденном состоянии одним неспаренным электроном,
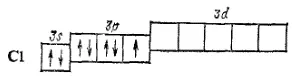
может быть переведен, при затрате некоторой энергии, в возбужденные состояния (Cl*), характеризующиеся тремя, пятью или семью неспаренными электронами;
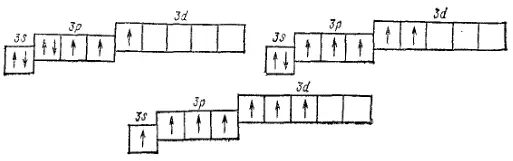
- 124 -
Поэтому, в отличие от атома фтора, атом хлора может участвовать в образовании не только одной, но также трех, пяти или семи ковалентных связей. Так. В хлористой кислоте HClO 2ковалентность хлора равна трем, в хлорноватой кислоте HClO 3— пяти, а в хлорной кислоте HClO 4— семи. Аналогично атом серы, также обладающий незанятым 3d-подуровнем, может переходить в возбужденные состояния с четырьмя или шестью неспаренными электронами и участвовать, следовательно, в образовании не только двух, как у кислорода, но также четырех или шести ковалентных связей. Этим можно объяснить существование соединений, в которых сера проявляет ковалентность, равную четырем (SO 2, SCl 4) или шести (SF 6).
Читать дальшеИнтервал:
Закладка:








